 | |
 | |
| Datos clinicos | |
|---|---|
| Pronunciación | / H ɛ p ər ɪ n / HEP -ər-in |
| AHFS / Drugs.com | Monografía |
Categoría de embarazo |
|
| Vías de administración | IV , SQ |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | Errático |
| Metabolismo | Hígado |
| Vida media de eliminación | 1,5 horas |
| Excreción | Orina [2] |
| Identificadores | |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA | 100.029.698 |
| Datos químicos y físicos | |
| Fórmula | C 12 H 19 N O 20 S 3 |
| Masa molar | 12000-15000 g / mol |
InChI
| |
| | |
La heparina , también conocida como heparina no fraccionada ( UFH ), es un medicamento y un glicosaminoglicano de origen natural . [3] [4] Como medicamento, se usa como anticoagulante (diluyente de la sangre). [3] Específicamente, también se usa en el tratamiento de ataques cardíacos y angina inestable . [3] Se administra mediante inyección en una vena o debajo de la piel . [3] Otros usos incluyen tubos de ensayo interiores y máquinas de diálisis renal . [4] [5]
Los efectos secundarios comunes incluyen sangrado, dolor en el lugar de la inyección y niveles bajos de plaquetas en sangre . [3] Los efectos secundarios graves incluyen trombocitopenia inducida por heparina . [3] Se necesita mayor cuidado en aquellos con función renal deficiente . [3] La heparina parece ser relativamente segura para su uso durante el embarazo y la lactancia . [6] La heparina es producida por basófilos y mastocitos en todos los mamíferos . [7]
El descubrimiento de la heparina se anunció en 1916. [8] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [9] También está disponible una versión fraccionada de heparina, conocida como heparina de bajo peso molecular . [10]
Uso médico [ editar ]
La heparina actúa como anticoagulante, evitando la formación de coágulos y la extensión de los coágulos existentes dentro de la sangre. Si bien la heparina en sí no descompone los coágulos que ya se han formado (a diferencia del activador del plasminógeno tisular ), permite que los mecanismos naturales de lisis de coágulos del cuerpo funcionen normalmente para descomponer los coágulos que se han formado. La heparina se usa generalmente como anticoagulante para las siguientes afecciones:
- Síndrome coronario agudo , p. Ej., NSTEMI
- Fibrilación auricular
- Trombosis venosa profunda y embolia pulmonar
- Bypass cardiopulmonar para cirugía cardíaca
- Circuito ECMO para soporte vital extracorpóreo
- Hemofiltración
- Mora venosos centrales o periféricas catéteres
La heparina y sus derivados de bajo peso molecular (por ejemplo, la enoxaparina , dalteparina , tinzaparina ) son eficaces en la prevención de vena profunda trombosis y pulmonar émbolos en personas en riesgo, [11] [12] pero no hay evidencia indica cualquiera es más eficaz que la otros en la prevención de la mortalidad. [13]
Efectos adversos [ editar ]
Un efecto secundario grave de la heparina es la trombocitopenia inducida por heparina (TIH), causada por una reacción inmunológica que convierte a las plaquetas en un objetivo de la respuesta inmunológica, lo que resulta en la degradación de las plaquetas, lo que causa trombocitopenia. Esta condición generalmente se revierte al suspender el tratamiento y, en general, se puede evitar con el uso de heparinas sintéticas. Además, una forma benigna de trombocitopenia se asocia con el uso temprano de heparina, que se resuelve sin suspender la heparina.
Se conocen dos efectos secundarios no hemorrágicos del tratamiento con heparina. La primera es la elevación de los niveles séricos de aminotransferasas , que se ha informado hasta en el 80% de los pacientes que reciben heparina. Esta anomalía no se asocia con disfunción hepática y desaparece una vez que se suspende el fármaco. La otra complicación es la hiperpotasemia , que ocurre en 5 a 10% de los pacientes que reciben heparina y es el resultado de la supresión de aldosterona inducida por heparina. La hiperpotasemia puede aparecer unos días después del inicio de la terapia con heparina. Más raramente, los efectos secundarios de la alopecia y la osteoporosis pueden ocurrir con el uso crónico.
Como ocurre con muchas drogas, las sobredosis de heparina pueden ser fatales. En septiembre de 2006, la heparina recibió publicidad en todo el mundo cuando tres bebés prematuros murieron después de que se les administrara por error una sobredosis de heparina en un hospital de Indianápolis. [14]
Contraindicaciones [ editar ]
Esta sección necesita citas adicionales para su verificación . ( Abril de 2017 ) ( Obtenga información sobre cómo y cuándo eliminar este mensaje de plantilla ) |
La heparina está contraindicada en personas con riesgo de hemorragia (especialmente en personas con presión arterial no controlada, enfermedad hepática y accidente cerebrovascular), enfermedad hepática grave o hipertensión grave. [15]
Antídoto para la heparina [ editar ]
Se ha administrado sulfato de protamina para contrarrestar el efecto anticoagulante de la heparina (1 mg por 100 unidades de heparina administradas durante las últimas cuatro horas). [16] Se puede usar en quienes sufren una sobredosis de heparina o para revertir el efecto de la heparina cuando ya no se necesita. [17]
Función fisiológica [ editar ]
El papel normal de la heparina en el cuerpo no está claro. La heparina generalmente se almacena dentro de los gránulos secretores de los mastocitos y se libera solo en la vasculatura en los sitios de lesión tisular. Se ha propuesto que, más que la anticoagulación, el propósito principal de la heparina es la defensa en tales sitios contra bacterias invasoras y otros materiales extraños. [18] Además, se observa en varias especies muy diferentes, incluidos algunos invertebrados que no tienen un sistema de coagulación sanguíneo similar. Es un glicosaminoglicano altamente sulfatado. Tiene la densidad de carga negativa más alta de todas las moléculas biológicas conocidas . [19]
Conservación evolutiva [ editar ]
Además del tejido bovino y porcino del que comúnmente se extrae la heparina de grado farmacéutico, también se ha extraído y caracterizado de:
- Turquía [20]
- Ballena [21]
- Camello dromedario [22]
- Ratón [23]
- Humanos [24]
- Langosta [25]
- Mejillón de agua dulce [26]
- Almeja [27]
- Camarones [28]
- Cangrejo de manglar [29]
- Dólar de arena [29]
- Salmón del Atlántico [30] [31]
- Pez cebra [32]
La actividad biológica de la heparina dentro de las especies 6-11 no está clara y apoya aún más la idea de que la función fisiológica principal de la heparina no es la anticoagulación. Estas especies no poseen ningún sistema de coagulación sanguínea similar al presente en las especies enumeradas 1-5. La lista anterior también demuestra cómo la heparina se ha conservado en gran medida evolutivamente , con moléculas de una estructura similar producidas por una amplia gama de organismos pertenecientes a muchos filos diferentes . [ cita requerida ]
Farmacología [ editar ]
En la naturaleza , la heparina es un polímero de diferente tamaño de cadena. La heparina no fraccionada (UFH) como producto farmacéutico es la heparina que no ha sido fraccionada para secuestrar la fracción de moléculas con bajo peso molecular . Por el contrario, la heparina de bajo peso molecular (HBPM) se ha fraccionado con el fin de hacer que su farmacodinámica sea más predecible. A menudo se pueden utilizar UFH o LMWH; en algunas situaciones es preferible uno u otro. [33]
Mecanismo de acción [ editar ]
La heparina se une al inhibidor de la enzima antitrombina III (AT), provocando un cambio conformacional que resulta en su activación a través de un aumento en la flexibilidad de su bucle de sitio reactivo. [34] El AT activado inactiva la trombina , el factor Xa y otras proteasas. La tasa de inactivación de estas proteasas por AT puede aumentar hasta 1000 veces debido a la unión de la heparina. [35] La heparina se une al AT a través de una secuencia de sulfatación de pentasacárido específica contenida en el polímero de heparina:
- GlcNAc / NS (6S) -GlcA-GlcNS (3S, 6S) -IdoA (2S) -GlcNS (6S)
El cambio conformacional en AT sobre la unión a heparina media su inhibición del factor Xa. Sin embargo, para la inhibición de la trombina, la trombina también debe unirse al polímero de heparina en un sitio próximo al pentasacárido. La densidad de carga altamente negativa de la heparina contribuye a su fuerte interacción electrostática con la trombina . [19] La formación de un complejo ternario entre AT, trombina y heparina da como resultado la inactivación de la trombina. Por esta razón, la actividad de la heparina contra la trombina depende del tamaño, y el complejo ternario requiere al menos 18 unidades de sacárido para una formación eficaz. [36] En contraste, la actividad del antifactor Xa a través de AT requiere solo el sitio de unión al pentasacárido.
Esta diferencia de tamaño ha llevado al desarrollo de heparinas de bajo peso molecular (HBPM) y fondaparinux como anticoagulantes. Fondaparinux se dirige a la actividad anti-factor Xa en lugar de inhibir la actividad de la trombina, con el objetivo de facilitar una regulación más sutil de la coagulación y un índice terapéutico mejorado. Es un pentasacárido sintético, cuya estructura química es casi idéntica a la secuencia de pentasacárido de unión a AT que se puede encontrar dentro de la heparina polimérica y el sulfato de heparán .
Con HBPM y fondaparinux, se reduce el riesgo de osteoporosis y trombocitopenia inducida por heparina (TIH). La monitorización del tiempo de tromboplastina parcial activada tampoco es necesaria y no refleja el efecto anticoagulante, ya que el TTPA es insensible a las alteraciones del factor Xa.
Danaparoid , una mezcla de heparán sulfato, dermatán sulfato y condroitín sulfato se puede utilizar como anticoagulante en pacientes que han desarrollado HIT. Debido a que danaparoid no contiene heparina o fragmentos de heparina, se informa que la reactividad cruzada de danaparoid con anticuerpos inducidos por heparina es inferior al 10%. [37]
Los efectos de la heparina se miden en el laboratorio mediante el tiempo de tromboplastina parcial ( aPTT ), una de las medidas del tiempo que tarda el plasma sanguíneo en coagularse. El tiempo de tromboplastina parcial no debe confundirse con el tiempo de protrombina , o TP, que mide el tiempo de coagulación de la sangre a través de una vía diferente de la cascada de coagulación .
Administración [ editar ]
La heparina se administra por vía parenteral porque no se absorbe en el intestino, debido a su alta carga negativa y su gran tamaño. Puede inyectarse por vía intravenosa o subcutánea (debajo de la piel); Se evitan las inyecciones intramusculares (en el músculo) debido a la posibilidad de que se formen hematomas . Debido a su corta vida media biológica de aproximadamente una hora, la heparina debe administrarse con frecuencia o como una infusión continua . La heparina no fraccionada tiene una vida media de aproximadamente una a dos horas después de la infusión, [38] mientras que la HBPM tiene una vida media de cuatro a cinco horas. [39]El uso de HBPM ha permitido la dosificación una vez al día, por lo que no requiere una infusión continua del fármaco. Si se requiere anticoagulación a largo plazo, la heparina a menudo se usa solo para comenzar la terapia de anticoagulación hasta que surta efecto un anticoagulante oral, por ejemplo, warfarina .
El American College of Chest Physicians publica pautas clínicas sobre la dosificación de heparina. [40]
Degradación natural o aclaramiento [ editar ]
La heparina no fraccionada tiene una vida media de aproximadamente una a dos horas después de la infusión, [38] mientras que la vida media de la heparina de bajo peso molecular es aproximadamente cuatro veces más larga. Las dosis más bajas de heparina tienen una vida media mucho más corta que las más grandes. La unión de la heparina a las células de los macrófagos es internalizada y despolimerizada por los macrófagos. También se une rápidamente a las células endoteliales , lo que impide la unión a la antitrombina que da lugar a una acción anticoagulante. Para dosis más altas de heparina, la unión de las células endoteliales estará saturada, de modo que la eliminación de la heparina del torrente sanguíneo por los riñones será un proceso más lento. [41]
Química [ editar ]
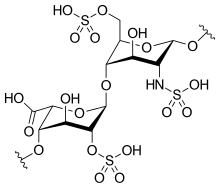
Estructura de la heparina [ editar ]
La heparina nativa es un polímero con un peso molecular que varía de 3 a 30 kDa , aunque el peso molecular promedio de la mayoría de las preparaciones comerciales de heparina está en el rango de 12 a 15 kDa. [42] La heparina es un miembro de la familia de carbohidratos de los glicosaminoglicanos (que incluye la molécula estrechamente relacionada heparán sulfato ) y consiste en una unidad de disacárido repetida sulfatada de manera variable . [43] A continuación se muestran las principales unidades de disacáridos que se encuentran en la heparina. La unidad de disacárido más común está compuesta por un ácido idurónico 2-O-sulfatadoy glucosamina 6-O-sulfatada, N-sulfatada, IdoA (2S) -GlcNS (6S). Por ejemplo, esto constituye el 85% de las heparinas de pulmón de res y aproximadamente el 75% de las de la mucosa intestinal porcina. [44]
No se muestran a continuación los disacáridos raros que contienen una glucosamina 3-O-sulfatada (GlcNS (3S, 6S)) o un grupo amina libre (GlcNH 3 + ). En condiciones fisiológicas, los grupos éster y amida sulfato se desprotonan y atraen contraiones cargados positivamente para formar una sal de heparina. La heparina generalmente se administra en esta forma como anticoagulante.
GlcA-GlcNAc GlcA-GlcNS IdoA-GlcNS IdoA (2S) -GlcNS IdoA-GlcNS (6S) IdoA (2S) -GlcNS (6S)
GlcA = β- D - ácido glucurónico , IdoA = α- L - ácido idurónico , IdoA (2S) = ácido 2- O -sulfo-α- L -idurónico, GlcNAc = 2-desoxi-2-acetamido-α- D - glucopiranosilo, GlcNS = 2-desoxi-2-sulfamido-α- D -glucopiranosilo, GlcNS (6S) = 2-desoxi-2-sulfamido-α- D -glucopiranosil-6- O -sulfato
Una unidad de heparina (la " unidad de Howell ") es una cantidad aproximadamente equivalente a 0,002 mg de heparina pura, que es la cantidad necesaria para mantener 1 ml de líquido sanguíneo de gato durante 24 horas a 0 ° C. [45]
Estructura tridimensional [ editar ]
La estructura tridimensional de la heparina es complicada porque el ácido idurónico puede estar presente en cualquiera de dos conformaciones de baja energía cuando se coloca internamente dentro de un oligosacárido. El equilibrio conformacional está influenciado por el estado de sulfatación de los azúcares glucosamínicos adyacentes. [46] Sin embargo, la estructura de la solución de un dodecasacárido de heparina compuesto únicamente por seis unidades repetidas GlcNS (6S) -IdoA (2S) se ha determinado utilizando una combinación de espectroscopía de RMN y técnicas de modelado molecular. [47] Se construyeron dos modelos, uno en el que todos los IdoA (2S) estaban en la conformación 2 S 0 ( A y B a continuación), y otro en el que están en el 1Conformación C 4 ( C y D a continuación). Sin embargo, ninguna evidencia sugiere que los cambios entre estas conformaciones ocurran de manera concertada. Estos modelos corresponden al código del banco de datos de proteínas 1HPN. [48]
En la imagen de arriba:
- A = 1HPN (todos los residuos IdoA (2S) en conformación 2 S 0 ) Visor Jmol
- B = modelo de llenado de espacio de radio de van der Waals de A
- C = 1HPN (todos los residuos IdoA (2S) en la conformación 1 C 4 ) Visor Jmol
- D = modelo de llenado de espacio de radio de van der Waals de C
En estos modelos, la heparina adopta una conformación helicoidal, cuya rotación coloca grupos de grupos sulfato a intervalos regulares de aproximadamente 17 angstroms (1,7 nm ) a cada lado del eje helicoidal.
Técnicas de despolimerización [ editar ]
Las técnicas de despolimerización química o enzimática o una combinación de ambas son la base de la gran mayoría de los análisis realizados sobre la estructura y función de la heparina y el heparán sulfato (HS).
Enzimático [ editar ]
Las enzimas utilizadas tradicionalmente para digerir la heparina o HS son producidas naturalmente por la bacteria del suelo Pedobacter heparinus (anteriormente llamada Flavobacterium heparinum ). [49] Esta bacteria es capaz de utilizar heparina o HS como su única fuente de carbono y nitrógeno. Para ello, produce una variedad de enzimas como liasas , glucuronidasas , sulfoesterasas y sulfamidasas . [50] Las liasas se han utilizado principalmente en estudios de heparina / HS. La bacteria produce tres liasas, heparinasas I ( EC 4.2.2.7 ), II (sin número EC asignado) y III ( EC 4.2.2.8) y cada uno tiene distintas especificidades de sustrato como se detalla a continuación. [51] [52]
| Enzima heparinasa | Especificidad del sustrato |
| Heparinasa I | GlcNS (± 6S) -IdoA (2S) |
| Heparinasa II | GlcNS / Ac (± 6S) -IdoA (± 2S) GlcNS / Ac (± 6S) -GlcA |
| Heparinasa III | GlcNS / Ac (± 6S) -GlcA / IdoA (con preferencia por GlcA) |
Las liasas escinden la heparina / HS mediante un mecanismo de eliminación beta . Esta acción genera un doble enlace insaturado entre C4 y C5 del residuo de uronato. [53] [54] El uronato insaturado C4-C5 se denomina ΔUA o UA. Es un cromóforo UV sensible (absorción máxima a 232 nm) y permite seguir la velocidad de una digestión enzimática, además de proporcionar un método conveniente para detectar los fragmentos producidos por digestión enzimática.
Química [ editar ]
El ácido nitroso se puede utilizar para despolimerizar químicamente la heparina / HS. El ácido nitroso se puede utilizar a un pH de 1,5 o a un pH más alto de 4. En ambas condiciones, el ácido nitroso efectúa la escisión desaminativa de la cadena. [55]
Tanto a pH "alto" (4) como a "bajo" (1,5), se produce una escisión desaminativa entre GlcNS-GlcA y GlcNS-IdoA, aunque a un ritmo más lento a un pH más alto. La reacción de desaminación y, por lo tanto, la escisión de la cadena, es independiente de la O-sulfatación llevada por cualquiera de las unidades de monosacárido.
A pH bajo, la escisión desaminativa da como resultado la liberación de SO 4 inorgánico y la conversión de GlcNS en anhidromanosa (aMan). El tratamiento con ácido nitroso de pH bajo es un método excelente para distinguir los polisacáridos N-sulfatados como la heparina y el HS de los polisacridos no N-sulfatados como el sulfato de condroitina y el sulfato de dermatán , el sulfato de condroitina y el sulfato de dermatán que no son susceptibles a la escisión del ácido nitroso.
Detección en fluidos corporales [ editar ]
Los análisis de laboratorio clínicos actuales para la heparina se basan en una medición indirecta del efecto del fármaco, más que en una medida directa de su presencia química. Estos incluyen el tiempo de tromboplastina parcial activado (APTT) y la actividad del antifactor Xa. La muestra de elección suele ser plasma fresco no hemolizado de sangre que ha sido anticoagulada con citrato, fluoruro u oxalato. [56] [57]
Historia [ editar ]
La heparina fue descubierta por Jay McLean y William Henry Howell en 1916, aunque no entró en ensayos clínicos hasta 1935. [58] Originalmente se aisló de células hepáticas de perro , de ahí su nombre ( hepar o "ήπαρ" es griego para "hígado" ; hepar + -in ).
McLean era un estudiante de segundo año de medicina en la Universidad Johns Hopkins y estaba trabajando bajo la dirección de Howell investigando preparaciones procoagulantes, cuando aisló un anticoagulante fosfátido soluble en grasa en tejido hepático canino. [59] En 1918, Howell acuñó el término "heparina" para este tipo de anticoagulante liposoluble. A principios de la década de 1920, Howell aisló un anticoagulante polisacárido soluble en agua , al que también denominó "heparina", aunque era diferente de las preparaciones de fosfátidos descubiertas anteriormente. [60] [61] El trabajo de McLean como cirujano probablemente cambió el enfoque del grupo de Howell para buscar anticoagulantes, lo que finalmente condujo al descubrimiento de polisacáridos.
En la década de 1930, varios investigadores estaban investigando la heparina. Erik Jorpes del Karolinska Institutet publicó su investigación sobre la estructura de la heparina en 1935, [62] que hizo posible que la empresa sueca Vitrum AB lanzara el primer producto de heparina para uso intravenoso en 1936. Entre 1933 y 1936, Connaught Medical Research Laboratories, que entonces formaba parte de la Universidad de Toronto, perfeccionó una técnica para producir heparina segura y no tóxica que se podía administrar a los pacientes en una solución salina. Los primeros ensayos en humanos de la heparina comenzaron en mayo de 1935 y, en 1937, estaba claro que la heparina de Connaught era segura, fácilmente disponible y eficaz como anticoagulante sanguíneo. Antes de 1933, la heparina estaba disponible en pequeñas cantidades, era extremadamente cara y tóxica y, como consecuencia, no tenía ningún valor médico. [63]
Otras funciones [ editar ]
- Los tubos de ensayo, Vacutainers y tubos capilares que utilizan la sal de litio de la heparina (heparina de litio) como anticoagulante suelen estar marcados con pegatinas verdes y tapas verdes. La heparina tiene la ventaja sobre el EDTA de no afectar los niveles de la mayoría de los iones . Sin embargo, los niveles de calcio ionizado pueden disminuir si la concentración de heparina en la muestra de sangre es demasiado alta. [64] Sin embargo, la heparina puede interferir con algunos inmunoensayos . Como generalmente se usa heparina de litio, los niveles de litio de una persona no se pueden obtener de estos tubos; para este fin, se utilizan vacutainer con superficie azul real (y superficie verde oscuro) que contienen heparina sódica .
- Los oxigenadores de sangre recubiertos de heparina están disponibles para su uso en máquinas de circulación extracorpórea . Entre otras cosas, se cree que estos oxigenadores especializados mejoran la biocompatibilidad general y la homeostasis del huésped al proporcionar características similares a las del endotelio nativo.
- Los sitios de unión del ADN en la ARN polimerasa pueden estar ocupados por heparina, evitando que la polimerasa se una al ADN promotor. Esta propiedad se explota en una variedad de ensayos biológicos moleculares.
- Los procedimientos de diagnóstico comunes requieren la amplificación por PCR del ADN de un paciente, que se extrae fácilmente de los glóbulos blancos tratados con heparina. Esto plantea un problema potencial, ya que la heparina se puede extraer junto con el ADN y se ha descubierto que interfiere con la reacción de PCR a niveles tan bajos como 0,002 U en una mezcla de reacción de 50 μL. [sesenta y cinco]
- La heparina se ha utilizado como resina cromatográfica , actuando como ligando de afinidad y como intercambiador de iones . [66] [67] [68] Su estructura polianiónica puede imitar ácidos nucleicos como el ADN y el ARN, lo que la hace útil para la purificación de proteínas de unión a ácidos nucleicos, incluidas las polimerasas de ADN y ARN y los factores de transcripción . [69] Afinidad específica de la heparina por VSV-G , [70] una glicoproteína de la envoltura viral que a menudo se usa para pseudotipificar vectores retrovirales y lentivirales. para terapia génica , permite su uso para la purificación posterior de vectores virales. [71] [72]
Sociedad y cultura [ editar ]
Recuerdos de contaminación [ editar ]
Teniendo en cuenta la fuente animal de heparina farmacéutica, el número de impurezas potenciales es relativamente grande en comparación con un agente terapéutico totalmente sintético. La gama de posibles contaminantes biológicos incluye virus, endotoxinas bacterianas, agentes de encefalopatía espongiforme transmisible (EET), lípidos, proteínas y ADN. Durante la preparación de heparina de calidad farmacéutica a partir de tejidos animales, se pueden introducir impurezas como disolventes, metales pesados y cationes extraños. Sin embargo, los métodos empleados para minimizar la aparición y para identificar y / o eliminar estos contaminantes están bien establecidos y se enumeran en las directrices y farmacopeas. El principal desafío en el análisis de impurezas de heparina es la detección e identificación de impurezas relacionadas estructuralmente.La impureza más prevalente en la heparina es el dermatán sulfato (DS), también conocido como condroitín sulfato B. El componente básico del DS es un disacárido compuesto de N-acetil galactosamina (GalN) unida a 1,3 y un residuo de ácido urónico, conectado a través de enlaces 1,4 para formar el polímero. El DS se compone de tres posibles bloques de construcción de ácido urónico (GlcA, IdoA o IdoA2S) y cuatro posibles hexosamina (GalNAc, Gal-NAc4S, GalNAc6S o GalNAc4S6S). La presencia de ácido idurónico en el DS lo distingue del sulfato de crondroitina A y C y lo compara con la heparina y el HS. El DS tiene una densidad de carga negativa más baja en general en comparación con la heparina. Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.El bloque de construcción de DS es un disacárido compuesto de N-acetil galactosamina (GalN) unida en 1,3 y un residuo de ácido urónico, conectados a través de enlaces 1,4 para formar el polímero. El DS se compone de tres posibles bloques de construcción de ácido urónico (GlcA, IdoA o IdoA2S) y cuatro posibles hexosamina (GalNAc, Gal-NAc4S, GalNAc6S o GalNAc4S6S). La presencia de ácido idurónico en el DS lo distingue del sulfato de crondroitina A y C y lo compara con la heparina y el HS. El DS tiene una densidad de carga negativa más baja en general en comparación con la heparina. Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.El bloque de construcción de DS es un disacárido compuesto de N-acetil galactosamina (GalN) unida en 1,3 y un residuo de ácido urónico, conectados a través de enlaces 1,4 para formar el polímero. El DS se compone de tres posibles bloques de construcción de ácido urónico (GlcA, IdoA o IdoA2S) y cuatro posibles hexosamina (GalNAc, Gal-NAc4S, GalNAc6S o GalNAc4S6S). La presencia de ácido idurónico en el DS lo distingue del sulfato de crondroitina A y C y lo compara con la heparina y el HS. El DS tiene una densidad de carga negativa más baja en general en comparación con la heparina. Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.El DS se compone de tres posibles bloques de construcción de ácido urónico (GlcA, IdoA o IdoA2S) y cuatro posibles hexosamina (GalNAc, Gal-NAc4S, GalNAc6S o GalNAc4S6S). La presencia de ácido idurónico en el DS lo distingue del sulfato de crondroitina A y C y lo compara con la heparina y el HS. El DS tiene una densidad de carga negativa más baja en general en comparación con la heparina. Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.El DS se compone de tres posibles bloques de construcción de ácido urónico (GlcA, IdoA o IdoA2S) y cuatro posibles hexosamina (GalNAc, Gal-NAc4S, GalNAc6S o GalNAc4S6S). La presencia de ácido idurónico en el DS lo distingue del sulfato de crondroitina A y C y lo compara con la heparina y el HS. El DS tiene una densidad de carga negativa más baja en general en comparación con la heparina. Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.Un contaminante natural común, el DS está presente en niveles de 1 a 7% en el API de heparina, pero no tiene actividad biológica comprobada que influya en el efecto anticoagulante de la heparina.[73]
En diciembre de 2007, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) retiró un envío de heparina debido al crecimiento bacteriano ( Serratia marcescens ) en varias jeringas sin abrir de este producto. S. marcescens puede provocar lesiones potencialmente mortales y / o la muerte. [74]
Retirada del mercado en 2008 debido a la adulteración de drogas en China [ editar ]
En marzo de 2008, la FDA anunció importantes retiradas del mercado de heparina debido a la contaminación de las existencias de heparina cruda importadas de China. [75] [76] Según la FDA, la heparina adulterada mató a casi 80 personas en los Estados Unidos. [77] El adulterante fue identificado como un derivado "sobre-sulfatado" del sulfato de condroitina , un popular suplemento derivado de mariscos que se usa a menudo para la artritis , que estaba destinado a sustituir la heparina real en las pruebas de potencia. [78]
Según el New York Times: "Los problemas con la heparina informados a la agencia incluyen dificultad para respirar, náuseas, vómitos, sudoración excesiva y presión arterial en rápida caída que en algunos casos llevaron a un shock potencialmente mortal".
Uso en homicidio [ editar ]
En 2006, Petr Zelenka , un enfermero de la República Checa , administró deliberadamente grandes dosis a los pacientes, mató a siete e intentó matar a otros diez. [79]
Problemas de sobredosis [ editar ]
En 2007, una enfermera del Centro Médico Cedars-Sinai les dio por error a los gemelos de 12 días del actor Dennis Quaid una dosis de heparina 1000 veces superior a la recomendada para bebés. [80] La sobredosis supuestamente se debió a que el etiquetado y el diseño de las versiones para adultos y para bebés del producto eran similares. Posteriormente, la familia Quaid demandó al fabricante, Baxter Healthcare Corp. , [81] [82] y llegó a un acuerdo con el hospital por $ 750.000. [83] Antes del accidente de Quaid, seis bebés recién nacidos en el Methodist Hospital en Indianápolis, Indiana, recibieron una sobredosis. Tres de los bebés murieron después del error. [84]
En julio de 2008, otro par de gemelos nacidos en el Christus Spohn Hospital South, en Corpus Christi, Texas , murió después de una sobredosis de la droga administrada accidentalmente. La sobredosis se debió a un error de mezcla en la farmacia del hospital y no estuvo relacionada con el empaque o etiquetado del producto. [85] En julio de 2008 [actualizar], se estaba investigando la causa exacta de la muerte de los gemelos. [86] [87]
En marzo de 2010, un paciente de dos años de Texas trasplantado recibió una dosis letal de heparina en el Centro Médico de la Universidad de Nebraska. Las circunstancias exactas que rodearon su muerte aún están bajo investigación. [88]
Producción [ editar ]
La heparina de grado farmacéutico se deriva de los tejidos de las mucosas de animales de carne sacrificados , como los intestinos porcinos (porcinos) o los pulmones de bovinos (bovinos). [89] Se realizaron avances para producir heparina sintéticamente en 2003 y 2008. [90] En 2011, se informó sobre un proceso quimioenzimático de síntesis de heparinas de bajo peso molecular a partir de disacáridos simples. [91]
Investigación [ editar ]
Como se detalla en la siguiente tabla, el potencial es grande para el desarrollo de estructuras similares a la heparina como fármacos para tratar una amplia gama de enfermedades , además de su uso actual como anticoagulantes. [92] [93]
| Estados patológicos sensibles a la heparina | Efecto de la heparina en modelos experimentales | Estado clínico |
| Síndrome de inmunodeficiencia adquirida | Reduce la capacidad de los virus de inmunodeficiencia humana tipos 1 y 2 para adsorberse en células T4 cultivadas. [94] | - |
| Síndrome de dificultad respiratoria del adulto | Reduce la activación y acumulación de células en las vías respiratorias, neutraliza mediadores y productos de células citotóxicas y mejora la función pulmonar en modelos animales. | Ensayos clínicos controlados |
| Encefalomielitis alérgica | Efectivo en modelos animales | - |
| Rinitis alérgica | Efectos como para el síndrome de dificultad respiratoria del adulto, aunque no se ha probado ningún modelo nasal específico | Ensayo clínico controlado |
| Artritis | Inhibe la acumulación de células, la destrucción del colágeno y la angiogénesis. | Informe anecdótico |
| Asma | Sin embargo, en cuanto al síndrome de dificultad respiratoria del adulto, también se ha demostrado que mejora la función pulmonar en modelos experimentales. | Ensayos clínicos controlados |
| Cáncer | Inhibe el crecimiento tumoral , la metástasis y la angiogénesis, y aumenta el tiempo de supervivencia en modelos animales. | Varios informes anecdóticos |
| Reacciones de hipersensibilidad de tipo retardado | Efectivo en modelos animales | - |
| Enfermedad inflamatoria intestinal | Inhibe el transporte de células inflamatorias en general, no se ha probado ningún modelo específico | Ensayos clínicos controlados |
| Cistitis intersticial | Efectivo en un modelo experimental humano de cistitis intersticial | Molécula relacionada que ahora se usa clínicamente |
| Rechazo de trasplantes | Prolonga la supervivencia del aloinjerto en modelos animales | - |
- - indica que no hay información disponible
Como resultado del efecto de la heparina sobre una variedad tan amplia de estados patológicos, se están desarrollando varios fármacos cuyas estructuras moleculares son idénticas o similares a las que se encuentran dentro de partes de la cadena polimérica de heparina. [92]
| Molécula de fármaco | Efecto de un nuevo fármaco en comparación con la heparina | Actividades biologicas |
| Tetrasacárido de heparina | No anticoagulante, no inmunogénico, activo por vía oral | Anti alergico |
| Polisulfato de pentosano | Derivado de plantas, poca actividad anticoagulante, antiinflamatorio, activo por vía oral | Antiinflamatorio, antiadhesivo, antimetastásico |
| Sulfato de fosfomannopentanosa | Potente inhibidor de la actividad heparanasa | Antimetastásico, antiangiogénico, antiinflamatorio |
| Heparina selectivamente O-desulfatada químicamente | Carece de actividad anticoagulante | Antiinflamatorio, antialérgico, antiadhesivo |
Referencias [ editar ]
- ^ Inyección de heparina sódica. Archivado el 5 de septiembre de 2013 en la Wayback Machine.
- ^ heparina. En: Lexi-Drugs Online [base de datos en Internet]. Hudson (OH): Lexi-Comp, Inc .; 2007 [citado 2/10/12]. Disponible en: http://online.lexi.com Archivado el 15 de febrero de 2012 en Wayback Machine . Se requiere suscripción para ver.
- ^ a b c d e f g "Heparina sódica" . La Sociedad Estadounidense de Farmacéuticos del Sistema de Salud. Archivado desde el original el 27 de enero de 2016 . Consultado el 1 de enero de 2016 .
- ^ a b "Inyección de heparina (mucosa) BP - Resumen de las características del producto (SPC) - (eMC)" . www.medicines.org.uk . Septiembre de 2016. Archivado desde el original el 20 de diciembre de 2016 . Consultado el 15 de diciembre de 2016 .
- ^ McClatchey, Kenneth D. (2002). Medicina de laboratorio clínico . Lippincott Williams y Wilkins. pag. 662. ISBN 9780683307511. Archivado desde el original el 10 de septiembre de 2017.
- ^ "Advertencias de embarazo y lactancia con heparina" . drugs.com . Archivado desde el original el 27 de enero de 2016 . Consultado el 15 de enero de 2016 .
- ^ Guyton, AC; Hall, JE (2006). Libro de texto de fisiología médica . Elsevier Saunders. pag. 464. ISBN 978-0-7216-0240-0.
- ^ Li, Jie Jack; Corey, EJ (2013). Descubrimiento de fármacos: prácticas, procesos y perspectivas . John Wiley e hijos. pag. 189. ISBN 9781118354469. Archivado desde el original el 10 de septiembre de 2017.
- ^ Organización Mundial de la Salud (2019). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 21a lista 2019 . Ginebra: Organización Mundial de la Salud. hdl : 10665/325771 . WHO / MVP / EMP / IAU / 2019.06. Licencia: CC BY-NC-SA 3.0 IGO.
- ^ Rietschel, Robert L .; Fowler, Joseph F .; Fisher, Alexander A. (2008). Dermatitis de contacto de Fisher . PMPH-USA. pag. 142. ISBN 9781550093780. Archivado desde el original el 10 de septiembre de 2017.
- ^ Agnelli G; Piovella F; Buoncristiani P; et al. (1998). "Enoxaparina más medias de compresión en comparación con medias de compresión solas en la prevención de la tromboembolia venosa después de la neurocirugía electiva". N Engl J Med . 339 (2): 80–85. doi : 10.1056 / NEJM199807093390204 . PMID 9654538 .
- ^ Bergqvist D; Agnelli G; Cohen AT; et al. (2002). "Duración de la profilaxis contra el tromboembolismo venoso con enoxaparina después de la cirugía por cáncer". N Engl J Med . 346 (13): 975–980. doi : 10.1056 / NEJMoa012385 . PMID 11919306 .
- ^ Handoll HH, Farrar MJ, McBirnie J, Tytherleigh-Strong G, Milne AA, Gillespie WJ (2002). "Heparina, heparina de bajo peso molecular y métodos físicos para prevenir la trombosis venosa profunda y la embolia pulmonar después de una cirugía para fracturas de cadera" . Cochrane Database Syst Rev (4): CD000305. doi : 10.1002 / 14651858.CD000305 . PMC 7043307 . PMID 12519540 .
- ^ Kusmer, Ken (20 de septiembre de 2006). "3er bebé prematuro de Ind. Muere de sobredosis" . Fox News. Associated Press. Archivado desde el original el 18 de octubre de 2007 . Consultado el 8 de enero de 2007 .
- ^ Manual de medicamentos australianos 2019 (en línea). Adelaide: Australian Medicines Handbook Pty Ltd; 2019 enero. Disponible en: https://amhonline.amh.net.au/
- ^ Medicina interna , Jay H. Stein, p. 635
- ^ "Sulfato de protamina" . La Sociedad Estadounidense de Farmacéuticos del Sistema de Salud. Archivado desde el original el 6 de noviembre de 2016 . Consultado el 8 de diciembre de 2016 .
- ^ Nader, HB; Chavante, SF; Dos-Santos, EA; Oliveira, FW; De-Paiva, JF; Jerônimo, SMB; Medeiros, GF; De-Abreu, LRD; et al. (1999). "Heparán sulfatos y heparinas: ¿compuestos similares que realizan las mismas funciones en vertebrados e invertebrados?" . Braz. J. Med. Biol. Res . 32 (5): 529–538. doi : 10.1590 / S0100-879X1999000500005 . PMID 10412563 .
- ^ a b Cox, M .; Nelson D. (2004). Lehninger, Principios de bioquímica . Hombre libre. pag. 254 . ISBN 978-0-7167-4339-2.
- ^ Warda M .; Mao W .; et al. (2003). "¿Intestino de pavo como fuente comercial de heparina? Estudios estructurales comparativos de glicosaminoglicanos de aves y mamíferos intestinales". Comp. Biochem. Physiol. B Biochem. Mol. Biol . 134 (1): 189-197. doi : 10.1016 / S1096-4959 (02) 00250-6 . PMID 12524047 .
- ^ Ototani N, Kikuchi M, Yosizawa Z (1981). "Estudios comparativos sobre las estructuras de formas altamente activas y relativamente inactivas de heparina de ballena". J. Biochem . 90 (1): 241–6. doi : 10.1093 / oxfordjournals.jbchem.a133456 . PMID 7287679 .
- ^ Warda M; Gouda EM .; et al. (2003). "Aislamiento y caracterización de heparina cruda de intestino dromedario: evaluación de una nueva fuente de heparina farmacéutica". Comp. Biochem. Physiol. C Toxicol. Pharmacol . 136 (4): 357–365. doi : 10.1016 / j.cca.2003.10.009 . PMID 15012907 .
- ^ Bland CE; Ginsburg H .; et al. (mil novecientos ochenta y dos). "Proteoglicano de heparina de ratón. Síntesis por monocapas de mastocitos-fibroblasto durante la proliferación de mastocitos dependiente de linfocitos". J. Biol. Chem . 257 (15): 8661–8666. PMID 6807978 .
- ^ Linhardt RJ; Ampofo SA .; et al. (1992). "Aislamiento y caracterización de heparina humana". Bioquímica . 31 (49): 12441–12445. doi : 10.1021 / bi00164a020 . PMID 1463730 .
- ^ Hovingh P, Enlazador A (1982). "Un inusual heparán sulfato aislado de langostas (Homarus americanus)". J. Biol. Chem . 257 (16): 9840–9844. PMID 6213614 .
- ^ Hovingh P, Enlazador A (1993). "Glucosaminoglicanos en Anodonta californiensis , un mejillón de agua dulce" . Biol. Bull . 185 (2): 263–276. doi : 10.2307 / 1542006 . JSTOR 1542006 . PMID 27768418 . Archivado desde el original el 27 de septiembre de 2007 . Consultado el 22 de marzo de 2007 .
- ^ Pejler G; Danielsson A .; et al. (1987). "Estructura y propiedades de unión a antitrombina de la heparina aislada de las almejas Anomalocardia brasiliana y Tivela mactroides". J. Biol. Chem . 262 (24): 11413-11421. PMID 3624220 .
- ^ Dietrich CP; Paiva JF .; et al. (1999). "Características estructurales y actividades anticoagulantes de una nueva heparina natural de bajo peso molecular del camarón Penaeus brasiliensis". Biochim. Biophys. Acta . 1428 (2–3): 273–283. doi : 10.1016 / S0304-4165 (99) 00087-2 . PMID 10434045 .
- ^ a b Medeiros GF; Mendes; A.; et al. (2000). "Distribución de glicosaminoglicanos sulfatados en el reino animal: ocurrencia generalizada de compuestos similares a la heparina en invertebrados". Biochim. Biophys. Acta . 1475 (3): 287-294. doi : 10.1016 / S0304-4165 (00) 00079-9 . PMID 10913828 .
- ^ Flengsrud, Ragnar; Larsen, Mette Lie; Ødegaard, Ole Rasmus (2010). "Purificación, caracterización y estudios in vivo de heparina de salmón". Investigación sobre trombosis . 126 (6): e409 – e417. doi : 10.1016 / j.thromres.2010.07.004 . ISSN 0049-3848 . PMID 20937523 .
- ^ Flengsrud R (2016). "Análisis de disacáridos de condroitina y heparina de salmón del Atlántico cultivado". Diario de glucoconjugado . 33 (2): 121-123. doi : 10.1007 / s10719-016-9652-8 . hdl : 11250/2388232 . PMID 26993287 . S2CID 671954 .
- ^ Zhang, echando humo; Zhang, Zhenqing; Thistle, Robert; McKeen, Lindsey; Hosoyama, Saori; Toida, Toshihiko; Linhardt, Robert J .; Page-McCaw, Patrick (2008). "Caracterización estructural de glicosaminoglicanos de pez cebra en diferentes edades" . Diario de glucoconjugado . 26 (2): 211–218. doi : 10.1007 / s10719-008-9177-x . ISSN 0282-0080 . PMC 2643322 . PMID 18777207 .
- ^ Hetzel, GR; et al. (2005), "Las heparinas: todo lo que un nefrólogo debe saber", Nephrol Dial Transplant , 20 (10): 2036-2042, doi : 10.1093 / ndt / gfi004 , PMID 16030035 .
- ^ Chuang YJ; Swanson R .; et al. (2001). "La heparina mejora la especificidad de la antitrombina para la trombina y el factor Xa independientemente de la secuencia del bucle del centro reactivo. Evidencia de un determinante exosito de la especificidad del factor Xa en la antitrombina activada por heparina" . J. Biol. Chem . 276 (18): 14961–14971. doi : 10.1074 / jbc.M011550200 . PMID 11278930 .
- ^ Bjork I, Lindahl U .; Lindahl (1982). "Mecanismo de la acción anticoagulante de la heparina". Mol. Celda. Biochem . 48 (3): 161–182. doi : 10.1007 / BF00421226 . PMID 6757715 . S2CID 29785682 .
- ^ Herbert, Jean-Marc; Petitou, Maurice; Hérault, Jean-Pascal; Bernat, André; et al. (1999). "Síntesis de miméticos de heparina inhibidores de trombina sin efectos secundarios". Naturaleza . 398 (6726): 417–422. Código Bibliográfico : 1999Natur.398..417P . doi : 10.1038 / 18877 . ISSN 0028-0836 . PMID 10201371 . S2CID 4339441 .
- ^ Shalansky, Karen. DANAPAROID (Orgaran) para la trombocitopenia inducida por heparina. Archivado el 28 de septiembre de 2007 en elCentro de Ciencias de la Salud y Hospital Wayback Machine de Vancouver, febrero de 1998 Boletín informativo sobre fármacos y terapias. Consultado el 8 de enero de 2007.
- ^ a b Eikelboom JW, Hankey GJ; Hankey (2002). "Heparinas y heparinoides de bajo peso molecular" . La Revista Médica de Australia . 177 (7): 379–383. doi : 10.5694 / j.1326-5377.2002.tb04807.x . PMID 12358583 . S2CID 25553190 . Archivado desde el original el 9 de septiembre de 2011.
- ^ Weitz JI (2004). "Nuevos anticoagulantes para el tratamiento del tromboembolismo venoso" . Circulación . 110 (9 Suppl 1): I19–26. doi : 10.1161 / 01.CIR.0000140901.04538.ae . PMID 15339877 .
- ^ Hirsh, Jack; Raschke, Robert (septiembre de 2004). "Heparina y heparina de bajo peso molecular: la séptima conferencia de la ACCP sobre terapia antitrombótica y trombolítica". Pecho . 126 (3): 188S – 203S. doi : 10.1378 / chest.126.3_suppl.188S . PMID 15383472 .
- ^ Weitz DS, Weitz JI; Weitz (2010). "Actualización sobre heparina: ¿qué necesitamos saber?". Revista de trombosis y trombólisis . 29 (2): 199–207. doi : 10.1007 / s11239-009-0411-6 . PMID 19882363 . S2CID 33367673 .
- ^ Francis CW, Kaplan KL (2006). "Capítulo 21. Principios de la terapia antitrombótica" . En Lichtman MA, Beutler E, Kipps TJ, et al. (eds.). Williams Hematology (7ª ed.). ISBN 978-0-07-143591-8. Archivado desde el original el 7 de julio de 2011.
- ^ Bentolila, A .; et al. (2000). "Síntesis y actividad biológica similar a la heparina de polímeros basados en aminoácidos". Polímeros para tecnologías avanzadas . 11 (8-12): 377-387. doi : 10.1002 / 1099-1581 (200008/12) 11: 8/12 <377 :: AID-PAT985> 3.0.CO; 2-D .
- ^ Gatti, G .; Casu, B .; Hamer, GK; Perlin, AS (1979). "Estudios sobre la conformación de la heparina por espectroscopia de RMN de 1H y 13C". Macromoléculas . 12 (5): 1001–1007. Código Bibliográfico : 1979MaMol..12.1001G . doi : 10.1021 / ma60071a044 . ISSN 0024-9297 .
- ^ "Diccionario médico en línea" . Centro de Educación sobre el Cáncer. 2000. Archivado desde el original el 13 de agosto de 2007 . Consultado el 11 de julio de 2008 .
- ^ Ferro D, Provasoli A, et al. (1990). "Poblaciones de conformadores de residuos de ácido L-idurónico en secuencias de glicosaminoglicanos". Carbohidr. Res . 195 (2): 157-167. doi : 10.1016 / 0008-6215 (90) 84164-P . PMID 2331699 .
- ^ Mulloy B, Forster MJ, Jones C, Davies DB (1 de enero de 1993). "Estudios de RMN y modelado molecular de la conformación en solución de heparina" . Biochem. J . 293 (Pt 3): 849–858. doi : 10.1042 / bj2930849 . PMC 1134446 . PMID 8352752 .
- ^ B. Mulloy, MJ Forster. "Estudios de RMN y modelado molecular de la conformación en solución de heparina" .
- ^ Shaya D; Tocilj A .; et al. (2006). "Estructura cristalina de la heparinasa II de Pedobacter heparinus y su complejo con un producto disacárido" . J. Biol. Chem . 281 (22): 15525-15535. doi : 10.1074 / jbc.M512055200 . PMID 16565082 .
- ^ Galliher PM; Cooney CL .; et al. (1981). "Producción de heparinasa por Flavobacterium heparinum" . Apl. Reinar. Microbiol . 41 (2): 360–365. doi : 10.1128 / AEM.41.2.360-365.1981 . PMC 243699 . PMID 7235692 .
- ^ Linhardt RJ; Turnbull JE .; et al. (1990). "Examen de la especificidad de sustrato de heparina y heparán sulfato liasas". Bioquímica . 29 (10): 2611–2617. doi : 10.1021 / bi00462a026 . PMID 2334685 .
- ^ Desai UR; Wang HM .; Linhardt RJ. (1993). "Estudios de especificidad sobre las heparinas liasas de Flavobacterium heparinum". Bioquímica . 32 (32): 8140–8145. doi : 10.1021 / bi00083a012 . PMID 8347612 .
- ^ Enlazador A, Hovingh P .; Hovingh (1972). "Aislamiento y caracterización de oligosacáridos obtenidos a partir de heparina por acción de heparinasa". Bioquímica . 11 (4): 563–568. doi : 10.1021 / bi00754a013 . PMID 5062409 .
- ^ Linhardt RJ; Rice KG .; et al. (1988). "Mapeo y cuantificación de los principales componentes oligosacáridos de la heparina" . Biochem. J . 254 (3): 781–787. doi : 10.1042 / bj2540781 . PMC 1135151 . PMID 3196292 .
- ^ Shively JE, Conrad HE .; Conrad (1976). "Formación de anhidroazúcares en la despolimerización química de heparina". Bioquímica . 15 (18): 3932–3942. doi : 10.1021 / bi00663a005 . PMID 9127 .
- ↑ Hansen R, Koster A, Kukucka M, Mertzlufft F, Kuppe H (2000). "Un rápido ensayo de coagulación de sangre entera basado en actividad anti-Xa para controlar la heparina no fraccionada durante el bypass cardiopulmonar: una investigación piloto". Anesth. Analg . 91 (3): 533–538. doi : 10.1213 / 00000539-200009000-00006 . PMID 10960371 . S2CID 44678237 .
- ^ R. Baselt, Disposición de fármacos y productos químicos tóxicos en el hombre , octava edición, Publicaciones biomédicas, Foster City, CA, 2008, págs. 728–729.
- ^ "Heparina utilizada como anticoagulante" . AnimalResearch.info. Archivado desde el original el 23 de octubre de 2013.
- ^ MCLEAN, J. (1 de enero de 1959). "El descubrimiento de la heparina" . Circulación . 19 (1): 75–78. doi : 10.1161 / 01.CIR.19.1.75 . PMID 13619023 .
- ^ Howell, W H. (1922). "Heparina, un anticoagulante". Soy. J. Physiol . 63 : 434–435.
- ^ Mueller RL, Scheidt S (1994). "Historia de los fármacos para la enfermedad trombótica. Descubrimiento, desarrollo y direcciones para el futuro" . Circulación . 89 (1): 432–449. doi : 10.1161 / 01.cir.89.1.432 . PMID 8281678 .
- ^ Jorpes E (agosto de 1935). "La química de la heparina" . La revista bioquímica . 29 (8): 1817–1830. doi : 10.1042 / bj0291817 . PMC 1266692 . PMID 16745848 .
- ^ Rutty, CJ. "Lubricante de sangre milagrosa: Connaught y la historia de la heparina, 1928-1937" . Servicios de investigación del patrimonio sanitario. Archivado desde el original el 23 de agosto de 2007 . Consultado el 21 de mayo de 2007 .
- ^ Higgins, C. (octubre de 2007). "El uso de heparina en la preparación de muestras para análisis de gases en sangre" (PDF) . Observador de Laboratorio Médico . 39 (10): 16–8, 20, cuestionario 22-3. PMID 18018679 . Archivado desde el original (PDF) el 10 de septiembre de 2016 . Consultado el 18 de abril de 2016 .
- ^ Yokota M, Tatsumi N, Nathalang O, Yamada T, Tsuda I (1999). "Efectos de la heparina sobre la reacción en cadena de la polimerasa para los glóbulos blancos" . J. Clin. Laboratorio. Anal . 13 (3): 133–40. doi : 10.1002 / (SICI) 1098-2825 (1999) 13: 3 <133 :: AID-JCLA8> 3.0.CO; 2-0 . PMC 6807949 . PMID 10323479 .
- ^ Xiong S, Zhang L, He QY (2008). "Fraccionamiento de proteínas por cromatografía de heparina" . PÁGINA 2D: Preparación y fraccionamiento de muestras . Métodos Mol Biol . Métodos en Biología Molecular ™. 424 . págs. 213-21 . doi : 10.1007 / 978-1-60327-064-9_18 . ISBN 978-1-58829-722-8. PMID 18369865 .
- ^ "Cromatografía de afinidad" . Sigma-Aldrich . Archivado desde el original el 7 de mayo de 2016.
- ^ "HiTrap Heparin HP" . GE Healthcare Life Sciences . Archivado desde el original el 1 de agosto de 2017.
- ^ "Realización de una separación de proteínas de unión al ADN con productos de GE Healthcare basados en heparina" . Sigma-Aldrich . Consultado el 16 de abril de 2019 .
- ^ Guibinga GH, Miyanohara A, Esko JD, Friedmann T (mayo de 2002). "El sulfato de heparina de la superficie celular es un receptor para la unión de partículas similares a retrovirus sin proteínas de la envoltura y vectores retrovíricos derivados de MLV pseudotipados de VSV-G a células diana" . Mol Ther . 1 (5): 538–546. doi : 10.1006 / mthe.2002.0578 . PMID 11991744 .
- ^ Segura MM, Kamen A, Garnier A (2008). "Purificación de partículas de retrovirus mediante cromatografía de afinidad de heparina". Protocolos de terapia génica . Métodos Mol Biol. 434 . págs. 1-11. doi : 10.1007 / 978-1-60327-248-3_1 . ISBN 978-1-60327-247-6. PMID 18470635 .
- ^ Segura MM, Kamen A, trudel P, Garnier A (20 de mayo de 2005). "Una nueva estrategia de purificación para vectores de terapia génica de tetrovirus utilizando cromatografía de afinidad de heparina". Biotechnol Bioeng . 4 (90): 391–404. doi : 10.1002 / bit.20301 . PMID 15812800 .
- ^ Beni S, Limtiaco JF, Larive CK (septiembre de 2011). "Análisis y caracterización de impurezas de heparina" . Química analítica y bioanalítica . 399 (2): 527–539. doi : 10.1007 / s00216-010-4121-x . PMC 3015169 . PMID 20814668 .
- ^ AM2 PAT, Inc. publica el retiro a nivel nacional de la solución de lavado de heparina precargada USP (5 ml en jeringas de 12 ml) Archivado 2007-12-23 en Wayback Machine , Am2pat, Inc. Comunicado de prensa, 20 de diciembre de 2007 [ fallido verificación ]
- ^ CBS News, fármaco anticoagulante bajo sospecha Archivado el 23 de octubre de 2012 en la Wayback Machine.
- ^ Página informativa de la FDA Archivada el 15 de abril de 2012 en Wayback Machine con información y enlaces sobre la investigación de la FDA.
- ^ Darby, Nigel (18 de septiembre de 2018). "El pasado y el futuro de la gestión de riesgos de procesos y materias primas en biofabricación" . Descubrimiento de drogas en línea . VertMarkets. Una cadena de suministro bajo escrutinio . Consultado el 1 de noviembre de 2018 .
- ^ Zawisza, Julie (29 de marzo de 2008). "Informe de prensa de la FDA sobre la heparina" (PDF) . Administración de Drogas y Alimentos de los Estados Unidos . Archivado (PDF) desde el original el 6 de marzo de 2010 . Consultado el 23 de abril de 2008 .
- ^ La enfermera cometió asesinatos para "probar" a los médicos. Archivado el 24 deseptiembre de 2009en la Wayback Machine , Radio Praha, 12 de mayo de 2006.
- ^ Ornstein, Charles; Gorman, Anna. (21 de noviembre de 2007) Informe de Los Angeles Times : Los gemelos de Dennis Quaid sufren una sobredosis accidental. Archivado el 7 de marzo de 2008 en Wayback Machine.
- ^ Dennis Quaid y esposa demandan al fabricante de medicamentos Archivado el 28 de junio de 2010en Wayback Machine , USA Today, 4 de diciembre de 2007
- ^ Dennis Quaid presenta una demanda por accidente relacionado con las drogas Archivado el 4 de julio de 2008 en la Wayback Machine , Los Angeles Times, 5 de diciembre de 2007
- ^ Quaid recibió $ 750,000 por negligencia hospitalaria Archivado el 15 de abril de 2009en Wayback Machine , SFGate.com, 16 de diciembre de 2008
- ^ Historia de WTHR Archivada el 29 de junio de 2011 en la Wayback Machine sobre la sobredosis de Methodist Hospital
- ^ Declaración del Dr. Richard Davis, director médico, CHRISTUS Spohn Health System [ enlace muerto permanente ] , 10 de julio de 2008
- ^ Sobredosis de heparina de un vistazo en el hospital. Archivado el 25 deoctubre de 2008en la Wayback Machine , Dallas Morning News, 11 de julio de 2008.
- ^ " Funcionarios investigan la sobredosis de heparina de los bebés en el hospital de Texas. Archivado el 11 de julio de 2008 en la Wayback Machine ". ABC News . 11 de julio de 2008. Recuperado el 24 de julio de 2008.
- ^ " Sobredosis de heparina mata a un niño pequeño en el hospital, personal investigado Archivado el 20 de marzo de 2012 en la Wayback Machine ". "KETV Omaha". 31 de marzo de 2010.
- ^ Linhardt RJ, Gunay NS .; Gunay (1999). "Producción y procesamiento químico de heparinas de bajo peso molecular". Sem. Trombo. Hem . 3 : 5-16. PMID 10549711 .
- ^ Bhattacharya, Ananyo (agosto de 2008). "La síntesis del matraz promete heparina no contaminada" . Mundo de la química . Real Sociedad de Química. Archivado desde el original el 21 de octubre de 2012 . Consultado el 6 de febrero de 2011 .
- ^ Xu, Y .; Masuko, S .; Takieddin, M .; Xu, H .; Liu, R .; Jing, J .; Mousa, SA; Linhardt, RJ; Liu, J. (2011). "Síntesis quimioenzimática de heparinas homogéneas de peso molecular ultrabajo" . Ciencia . 334 (6055): 498–501. Código bibliográfico : 2011Sci ... 334..498X . doi : 10.1126 / science.1207478 . PMC 3425363 . PMID 22034431 .
- ^ a b Palanca R .; Página CP (2002). "Oportunidades de fármacos novedosos para la heparina". Nature Reviews Descubrimiento de medicamentos . 1 (2): 140-148. doi : 10.1038 / nrd724 . PMID 12120095 . S2CID 7334825 .
- ^ Coombe DR; Kett WC (2005). "Interacciones de heparán sulfato-proteína: potencial terapéutico a través de conocimientos estructura-función". Celda. Mol. Life Sci . 62 (4): 410–424. doi : 10.1007 / s00018-004-4293-7 . PMID 15719168 . S2CID 6380429 .
- ^ Baba M, Pauwels R, Balzarini J, Arnout J, Desmyter J, De Clercq E (1988). "Mecanismo del efecto inhibidor del sulfato de dextrano y la heparina sobre la replicación del virus de la inmunodeficiencia humana in vitro" . Proc. Natl. Acad. Sci. USA . 85 (16): 6132–6. Código bibliográfico : 1988PNAS ... 85.6132B . doi : 10.1073 / pnas.85.16.6132 . PMC 281919 . PMID 2457906 .
Lectura adicional [ editar ]
- Marcum JA (enero de 2000). "El origen de la disputa por el descubrimiento de la heparina" . Revista de Historia de la Medicina y Ciencias Afines . 55 (1): 37–66. doi : 10.1093 / jhmas / 55.1.37 . PMID 10734720 . S2CID 30050513 .
- Mulloy B, Hogwood J, Gray E, Lever R, Page CP (enero de 2016). "Farmacología de la heparina y fármacos relacionados" . Revisiones farmacológicas . 68 (1): 76-141. doi : 10.1124 / pr.115.011247 . PMID 26672027 .
Enlaces externos [ editar ]
| Wikimedia Commons tiene medios relacionados con las heparinas . |
- Historia de la heparina
- "Heparina" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.