 | |
| Nombres | |
|---|---|
| Nombre IUPAC sistemático Nitrato | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| ChemSpider | |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| NO- 3 | |
| Masa molar | 62,004 g · mol −1 |
| Ácido conjugado | Ácido nítrico |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
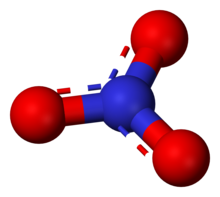
El nitrato es un ion poliatómico con la fórmula química NO-
3. Las sales que contienen este ion se denominan nitratos . Los nitratos son componentes comunes de fertilizantes y explosivos. [1] Casi todos los nitratos inorgánicos son solubles en agua . Un ejemplo de nitrato insoluble es el oxinitrato de bismuto .
Estructura [ editar ]
El ion es la base conjugada del ácido nítrico , que consta de un átomo de nitrógeno central rodeado por tres átomos de oxígeno unidos de forma idéntica en una disposición plana trigonal . El ion nitrato tiene una carga formal de -1. Esta carga es el resultado de una combinación de carga formal en la que cada uno de los tres oxígenos lleva una carga de -2 ⁄ 3 , mientras que el nitrógeno lleva una carga de +1, todo lo cual se suma a la carga formal del ion nitrato poliatómico. Esta disposición se usa comúnmente como ejemplo de resonancia . Como el carbonato isoelectrónico ion, el ion nitrato se puede representar mediante estructuras de resonancia:
Nitratos dietéticos [ editar ]
Una rica fuente de nitrato inorgánico en la dieta humana proviene de alimentos de hoja verde, como la espinaca y la rúcula . NO-
3(nitrato inorgánico) es el componente activo viable dentro del jugo de remolacha y otras verduras. El agua potable también es una fuente dietética. [2]
La suplementación dietética con nitratos ofrece resultados positivos al evaluar el rendimiento del ejercicio de resistencia. [3]
La ingestión de grandes dosis de nitrato, ya sea en forma de nitrato de sodio puro o jugo de remolacha en individuos jóvenes sanos, aumenta rápidamente la concentración de nitrato en plasma alrededor de 2-3 veces, y esta concentración elevada de nitrato puede mantenerse durante al menos 2 semanas. El aumento de nitrato plasmático estimula la producción de óxido nítrico. El óxido nítrico es una importante molécula de señalización fisiológica que se utiliza, entre otras cosas, en la regulación del flujo sanguíneo muscular y la respiración mitocondrial. [4]
Carnes curadas [ editar ]
El consumo de nitritos está determinado principalmente por la cantidad de carnes procesadas que se consumen y la concentración de nitratos en estas carnes. Aunque los nitritos son el compuesto de nitrógeno que se utiliza principalmente en el curado de la carne, también se utilizan nitratos. Los nitratos conducen a la formación de nitrosaminas . [5] La producción de nitrosaminas cancerígenas puede inhibirse mediante el uso de los antioxidantes vitamina C y la forma alfa-tocoferol de la vitamina E durante el curado. [6]
Las dietas antihipertensivas, como la dieta DASH , generalmente contienen altos niveles de nitratos, que primero se reducen a nitrito en la saliva, como se detecta en las pruebas de saliva , antes de formar óxido nítrico . [2]
Ocurrencia y producción [ editar ]
Las sales de nitrato se encuentran naturalmente en la tierra como grandes depósitos, particularmente de nitratina , una fuente importante de nitrato de sodio.
Los nitratos son producidos por una serie de especies de bacterias nitrificantes en el entorno natural que utilizan amoniaco o urea como fuente de nitrógeno. Los compuestos de nitrato para pólvora se producían históricamente, en ausencia de fuentes de nitrato mineral, mediante varios procesos de fermentación utilizando orina y estiércol.
Los rayos en la atmósfera rica en nitrógeno y oxígeno de la tierra producen una mezcla de óxidos de nitrógeno que forman iones nitrosos e iones nitrato que son lavados de la atmósfera por la lluvia o en depósitos ocultos .
Los nitratos se producen industrialmente a partir de ácido nítrico . [1]
Usos [ editar ]
Los nitratos se producen principalmente para su uso como fertilizantes en la agricultura debido a su alta solubilidad y biodegradabilidad. Los principales fertilizantes nitrogenados son las sales de amonio , sodio , potasio , calcio y magnesio . Se producen anualmente varios millones de kilogramos con este fin. [1]
La segunda gran aplicación de los nitratos es como agentes oxidantes, más notablemente en explosivos donde la rápida oxidación de compuestos de carbono libera grandes volúmenes de gases (ver pólvora para un ejemplo). El nitrato de sodio se utiliza para eliminar las burbujas de aire del vidrio fundido y algunas cerámicas. Se utilizan mezclas de sal fundida para endurecer algunos metales. [1]
Detección [ editar ]
Casi todos los métodos para la detección de nitrato se basan en su conversión a nitrito seguida de pruebas específicas de nitrito. La reducción de nitrato a nitrito se efectúa mediante material de cobre-cadmio. La muestra se introduce con un analizador de inyección de flujo y el efluente resultante que contiene nitrito se combina con un reactivo para la detección colorimétrica o electroquímica. El más popular de estos ensayos es la prueba de Griess , mediante la cual el nitrito se convierte en un colorante azoico de color intenso , adecuado para el análisis espectroscópico UV-vis. El método aprovecha la reactividad del ácido nitroso derivado de la acidificación del nitrito. El ácido nitroso reacciona selectivamente con aminas aromáticas para dar sales de diazonio, que a su vez se acoplan con un segundo reactivo para dar el tinte azo. El límite de detecciónes de 0,02 a 2 µM. [7] Los métodos se han adaptado en gran medida a las muestras biológicas. [8]
Seguridad [ editar ]
La toxicidad aguda del nitrato es baja. Existe un "desacuerdo sustancial" sobre los riesgos a largo plazo de la exposición a los nitratos. Las dos áreas de posible preocupación son que (i) el nitrato podría ser un precursor del nitrito en el intestino inferior, y el nitrito es un precursor de las nitrosaminas, que están implicadas en la carcinogénesis, y (ii) el nitrato está implicado en la metahemoglobinemia , un trastorno de la glóbulos rojos hemoglobina. [9] [10]
Metahemoglobinemia [ editar ]
Los nitratos no afectan a los bebés ni a las mujeres embarazadas. [11] [12] El síndrome del bebé azul es causado por una serie de otros factores, como malestar gástrico, como infecciones diarreicas, intolerancia a las proteínas, toxicidad por metales pesados, etc., y los nitratos juegan un papel menor. [13]
Normas para el agua potable [ editar ]
A través de la Ley de Agua Potable Segura, la Agencia de Protección Ambiental de los Estados Unidos ha establecido un nivel máximo de contaminantes de 10 mg / L o 10 ppm de nitratos en el agua potable. [14]
El Comité Mixto FAO / OMS de Expertos en Aditivos Alimentarios (JEFCA) estableció una ingesta diaria aceptable (IDA) de iones nitrato en el rango de 0 a 3,7 mg (kg de peso corporal) -1 día -1 . [15]
Toxicidad acuática [ editar ]
En sistemas de agua dulce o estuarinos cercanos a la tierra, el nitrato puede alcanzar concentraciones que son letales para los peces. Si bien el nitrato es mucho menos tóxico que el amoníaco, [16] niveles superiores a 30 ppm de nitrato pueden inhibir el crecimiento, dañar el sistema inmunológico y causar estrés en algunas especies acuáticas. [17] La toxicidad por nitratos sigue siendo objeto de debate. [18]
En la mayoría de los casos de concentraciones excesivas de nitrato en los sistemas acuáticos, las fuentes primarias son las descargas de aguas residuales, así como la escorrentía superficial de áreas agrícolas o ajardinadas que han recibido un exceso de fertilizante nitrogenado. La eutrofización resultante y la proliferación de algas dan como resultado anoxia y zonas muertas . Como consecuencia, como el nitrato forma un componente de los sólidos disueltos totales , se utilizan ampliamente como indicador de la calidad del agua .
Pienso para animales domésticos [ editar ]
Los síntomas de intoxicación por nitratos en animales domésticos incluyen aumento de la frecuencia cardíaca y la respiración; en casos avanzados, la sangre y los tejidos pueden tornarse de color azul o marrón. Los piensos pueden analizarse para detectar nitratos; El tratamiento consiste en complementar o sustituir los suministros existentes con material con menos nitratos. Los niveles inocuos de nitrato para varios tipos de ganado son los siguientes: [19]
| Categoría | % NO 3 | % NO 3 –N | % KNO 3 | Efectos |
|---|---|---|---|---|
| 1 | <0,5 | <0,12 | <0,81 | Generalmente seguro para ganado vacuno y ovino |
| 2 | 0,5-1,0 | 0,12-0,23 | 0,81–1,63 | Precaución: pueden aparecer algunos síntomas subclínicos en caballos gestantes, ovinos y bovinos de carne. |
| 3 | 1.0 | 0,23 | 1,63 | Problemas elevados de nitratos: pueden producirse muertes y abortos en ganado vacuno y ovino |
| 4 | <1,23 | <0,28 | <2,00 | Nivel máximo de seguridad para caballos. No alimente con forrajes con alto contenido de nitrato a las yeguas preñadas. |
Los valores anteriores son secos (sin humedad).
Sales y derivados covalentes [ editar ]
Formación de nitratos con elementos de la tabla periódica.
| HNO 3 | Él | ||||||||||||||||
| LiNO 3 | Sea (NO 3 ) 2 | B (NO3)- 4 | RONO 2 | NO- 3 NH 4 NO 3 | HOONO 2 | FNO 3 | Nordeste | ||||||||||
| NaNO 3 | Mg (NO 3 ) 2 | Al (NO 3 ) 3 | Si | PAG | S | ClONO 2 | Arkansas | ||||||||||
| KNO 3 | Ca (NO 3 ) 2 | Sc (NO 3 ) 3 | Ti (NO 3 ) 4 | VO (NO 3 ) 3 | Cr (NO 3 ) 3 | Mn (NO 3 ) 2 | Fe (NO 3 ) 2 Fe (NO 3 ) 3 | Co (NO 3 ) 2 Co (NO 3 ) 3 | Ni (NO 3 ) 2 | CuNO 3 Cu (NO 3 ) 2 | Zn (NO 3 ) 2 | Ga (NO 3 ) 3 | Ge | Como | Se | Br | Kr |
| RbNO 3 | Sr (NO 3 ) 2 | Y (NO 3 ) 3 | Zr (NO 3 ) 4 | Nótese bien | Mes | Tc | Ru (NO 3 ) 3 | Rh (NO 3 ) 3 | Pd (NO 3 ) 2 Pd (NO 3 ) 4 | AgNO 3 Ag (NO 3 ) 2 | Cd (NO 3 ) 2 | En (NO 3 ) 3 | Sn (NO 3 ) 4 | Sb (NO 3 ) 3 | Te | INO 3 | Xe (NO 3 ) 2 |
| CsNO 3 | Ba (NO 3 ) 2 | Hf (NO 3 ) 4 | Ejército de reserva | W | Re | Os | Ir | Pt (NO 3 ) 2 Pt (NO 3 ) 4 | Au (NO 3 ) 3 | Hg 2 (NO 3 ) 2 Hg (NO 3 ) 2 | TlNO 3 Tl (NO 3 ) 3 | Pb (NO 3 ) 2 | Bi (NO 3 ) 3 BiO (NO 3 ) | Po (NO 3 ) 4 | A | Rn | |
| FrNO 3 | Ra (NO 3 ) 2 | Rf | Db | Sg | Bh | Hs | Monte | Ds | Rg | Cn | Nueva Hampshire | Florida | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La (NO 3 ) 3 | Ce (NO 3 ) 3 Ce (NO 3 ) 4 | Pr (NO 3 ) 3 | Nd (NO 3 ) 3 | Pm (NO 3 ) 3 | Sm (NO 3 ) 3 | UE (NO 3 ) 3 | Gd (NO 3 ) 3 | Tb (NO 3 ) 3 | Dy (NO 3 ) 3 | Ho (NO 3 ) 3 | Er (NO 3 ) 3 | Tm (NO 3 ) 3 | Yb (NO 3 ) 3 | Lu (NO 3 ) 3 | |||
| Ac (NO 3 ) 3 | Th (NO 3 ) 4 | PaO 2 (NO 3 ) 3 | UO 2 (NO 3 ) 2 | Np (NO 3 ) 4 | Pu (NO 3 ) 4 | Soy (NO 3 ) 3 | Cm (NO 3 ) 3 | Bk | Cf | Es | Fm | Maryland | No | Lr | |||
Ver también [ editar ]
- Amonio
- relación f
- Nitrificación
- Nitratina
- Nitrito , el anión NO-
2 - Trióxido de nitrógeno , el radical neutro NO
3 - Peroxinitrato , OONO-
2 - Nitrato de sodio
Referencias [ editar ]
- ↑ a b c d Laue W, Thiemann M, Scheibler E, Wiegand KW (2006). "Nitratos y nitritos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a17_265 .
- ↑ a b Hord NG, Tang Y, Bryan NS (julio de 2009). "Fuentes alimentarias de nitratos y nitritos: el contexto fisiológico de posibles beneficios para la salud" . La Revista Estadounidense de Nutrición Clínica . 90 (1): 1–10. doi : 10.3945 / ajcn.2008.27131 . PMID 19439460 .
- ^ McMahon NF, Leveritt MD, Pavey TG (abril de 2017). "El efecto de la suplementación con nitratos en la dieta sobre el rendimiento del ejercicio de resistencia en adultos sanos: una revisión sistemática y un metaanálisis" (PDF) . Medicina deportiva (Auckland, Nueva Zelanda) . 47 (4): 735–756. doi : 10.1007 / s40279-016-0617-7 . PMID 27600147 . S2CID 207494150 .
- ^ Maughan, Ronald J (2013). Alimentación, nutrición y rendimiento deportivo III . Nueva York: Taylor & Francis. pag. 63. ISBN 978-0-415-62792-4.
- ^ Bingham SA, Hughes R, Cross AJ (noviembre de 2002). "Efecto de la carne blanca frente a la roja sobre la N-nitrosación endógena en el colon humano y más pruebas de una respuesta a la dosis" . La Revista de Nutrición . 132 (11 Suppl): 3522S – 3525S. doi : 10.1093 / jn / 132.11.3522S . PMID 12421881 .
- ^ Parthasarathy DK, Bryan NS (noviembre de 2012). "Nitrito de sodio: la" cura "para la insuficiencia de óxido nítrico". Ciencia de la carne . 92 (3): 274–9. doi : 10.1016 / j.meatsci.2012.03.001 . PMID 22464105 .
- ^ Moorcroft, M .; Davis, J .; Compton, RG (2001). "Detección y determinación de nitratos y nitritos: una revisión". Talanta . 54 (5): 785–803. doi : 10.1016 / S0039-9140 (01) 00323-X . PMID 18968301 .
- ^ Ellis, Graham; Adatia, Ian; Yazdanpanah, Mehrdad; Makela, Sinikka K. (1998). "Análisis de nitritos y nitratos: una perspectiva de bioquímica clínica". Bioquímica clínica . 31 (4): 195–220. doi : 10.1016 / S0009-9120 (98) 00015-0 . PMID 9646943 .
- ^ Powlson, David S .; Addiscott, Tom M .; Benjamin, Nigel; Cassman, Ken G .; De Kok, Theo M .; Van Grinsven, Hans; l'Hirondel, Jean-Louis; Avery, Alex A .; Van Kessel, Chris (2008). "¿Cuándo se convierte el nitrato en un riesgo para los seres humanos?" . Revista de Calidad Ambiental . 37 (2): 291–5. doi : 10.2134 / jeq2007.0177 . PMID 18268290 .
- ^ "Envenenamiento por nitratos y nitritos: Introducción" . El Manual veterinario de Merck . Consultado el 27 de diciembre de 2008 .
- ^ Addiscott, TM; Benjamín, N. (2006). "Nitrato y salud humana". Manejo y uso del suelo . 20 (2): 98-104. doi : 10.1111 / j.1475-2743.2004.tb00344.x .
- ^ AA Avery: metahemoglobinemia infantil: reexaminar el papel de los nitratos del agua potable , perspectivas de salud ambiental , volumen 107, número 7, julio de 1999.
- ^ Manassaram DM, Backer LC, Messing R, Fleming LE, Luke B, Monteilh CP (octubre de 2010). "Nitratos en el agua potable y niveles de metahemoglobina en el embarazo: un estudio longitudinal" . Salud ambiental . 9 (1): 60. doi : 10.1186 / 1476-069x-9-60 . PMC 2967503 . PMID 20946657 .
- ^ "4. ¿Cuáles son las regulaciones de agua potable de la EPA para el nitrato?" . Agua subterránea y agua potable . Consultado el 13 de noviembre de 2018 .
- ^ Bagheri, H .; Hajian, A .; Rezaei, M .; Shirzadmehr, A. (2017). "Compuesto de nanopartículas de metal Cu-nanotubos de carbono de paredes múltiples-óxido de grafeno reducido como una plataforma novedosa y de alto rendimiento del sensor electroquímico para la determinación simultánea de nitrito y nitrato". Revista de materiales peligrosos . 324 (Parte B): 762–772. doi : 10.1016 / j.jhazmat.2016.11.055 . PMID 27894754 .
- ^ Romano N, Zeng C (septiembre de 2007). "Toxicidad aguda del nitrato de sodio, nitrato de potasio y cloruro de potasio y sus efectos sobre la composición de la hemolinfa y la estructura branquial de los cangrejos nadadores azules juveniles tempranos (Portunus pelagicus Linnaeus, 1758) (Decapoda, Brachyura, Portunidae)". Toxicología y Química Ambiental . 26 (9): 1955–62. doi : 10.1897 / 07-144r.1 . PMID 17705664 .
- ^ Sharpe, Shirlie. "Nitratos en el acuario" . About.com . Consultado el 30 de octubre de 2013 .
- ^ Romano N, Zeng C (diciembre de 2007). "Efectos del potasio sobre alteraciones de la osmorregulación mediadas por nitratos en cangrejos marinos". Toxicología acuática . 85 (3): 202–8. doi : 10.1016 / j.aquatox.2007.09.004 . PMID 17942166 .
- ^ "Riesgo de nitrato en cultivos forrajeros - Preguntas frecuentes" . Agricultura y Desarrollo Rural . Gobierno de Alberta . Consultado el 30 de octubre de 2013 .
Enlaces externos [ editar ]
| Wikimedia Commons tiene medios relacionados con los nitratos . |
- ATSDR - Estudios de caso en medicina ambiental - Nitrato / Toxicidad de nitrito ( archivo )