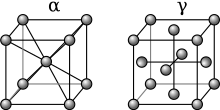
A presión atmosférica , existen tres formas alotrópicas de hierro : hierro alfa (α-Fe), hierro gamma (γ-Fe) y hierro delta (δ-Fe). A muy alta presión, existe una cuarta forma, llamada hierro épsilon (ε-Fe) . Algunas pruebas experimentales controvertidas sugieren la existencia de una quinta forma de alta presión que es estable a presiones y temperaturas muy altas. [1]
Las fases del hierro a presión atmosférica son importantes debido a las diferencias en la solubilidad del carbono , formando diferentes tipos de acero . Las fases de alta presión del hierro son importantes como modelos para las partes sólidas de los núcleos planetarios. En general, se supone que el núcleo interno de la Tierra consiste esencialmente en una aleación cristalina de hierro y níquel con estructura ε. [2] [3] [4] Se cree que el núcleo externo que rodea al núcleo interno sólido está compuesto de hierro líquido mezclado con níquel y trazas de elementos más ligeros.
Alótropos de presión estándar [ editar ]
Hierro alfa (α-Fe) [ editar ]
Por debajo de 912 ° C (1674 ° F), el hierro tiene una estructura cristalina cúbica centrada en el cuerpo (bcc) y se conoce como α-hierro o ferrita . Es termodinámicamente estable y un metal bastante blando. La α-Fe puede someterse a presiones de hasta aprox. 15 GPa antes de transformarse en una forma de alta presión denominada ε-Fe que se analiza a continuación.
Magnéticamente, el hierro α es paramagnético a altas temperaturas. Sin embargo, por debajo de su temperatura de Curie (T C o A 2 ) de 771 ° C (1044K o 1420 ° F), [5] , se vuelve ferromagnético . En el pasado, la forma paramagnética del α-hierro se conocía como Beta iron (β-Fe). [6] [7] A pesar de que la ligera distorsión tetragonal en el estado ferromagnético constituye una verdadera transición de fase, la naturaleza continua de esta transición tiene una importancia menor en el tratamiento térmico del acero . El A 2 forma el límite entre el hierro beta y los campos alfa en el diagrama de fase. en la Figura 1.
De manera similar, el A 2 es de menor importancia en comparación con las temperaturas críticas A 1 ( eutectoide ), A 3 y A cm . El A cm , donde la austenita está en equilibrio con la cementita + γ-Fe, está más allá del borde derecho en la Fig. 1. El campo de fase α + γ es, técnicamente, el campo β + γ por encima del A 2 . La designación beta mantiene la continuidad de la progresión de las fases en letras griegas en el hierro y el acero: α-Fe, β-Fe, austenita (γ-Fe), δ-Fe de alta temperatura y hexaferrum de alta presión (ε-Fe) .
La fase primaria del acero con bajo contenido de carbono o acero dulce y la mayoría de los hierros fundidos a temperatura ambiente es el α-Fe ferromagnético . [8] [9] Tiene una dureza de aproximadamente 80 Brinell . [10] [11] La solubilidad máxima es de aproximadamente 0,02% en peso a 727 ° C (1341 ° F) y 0,001% de carbono a 0 ° C (32 ° F). [12] Cuando se disuelve en hierro, los átomos de carbono ocupan "agujeros" intersticiales. Al tener aproximadamente el doble del diámetro del agujero tetraédrico , el carbono introduce un fuerte campo de deformación local.
El acero dulce ( acero al carbono con hasta aproximadamente 0,2% en peso de C) consiste principalmente en α-Fe y cantidades crecientes de cementita (Fe 3 C, un carburo de hierro). La mezcla adopta una estructura laminar denominada perlita . Dado que la bainita y la perlita contienen cada una α-Fe como componente, cualquier aleación de hierro-carbono contendrá alguna cantidad de α-Fe si se permite que alcance el equilibrio a temperatura ambiente. La cantidad de α-Fe depende del proceso de enfriamiento.
A 2 temperatura crítica y calentamiento por inducción [ editar ]
El β-Fe y la temperatura crítica A 2 son importantes en el calentamiento por inducción del acero, como en los tratamientos térmicos de endurecimiento de la superficie. El acero se típicamente austenitizado a 900-1000 ° C antes de que se inactivó y templado . El campo magnético alterno de alta frecuencia de calentamiento por inducción calienta el acero por dos mecanismos por debajo de la temperatura de Curie: calentamiento por resistencia o Joule (I 2 R) y pérdidas por histéresis ferromagnética . Por encima de A 2 , el mecanismo de histéresis desaparece y la cantidad de energía requerida por grado de aumento de temperatura es sustancialmente mayor que por debajo de A 2 . Es posible que se necesiten circuitos de adaptación de carga para variar laimpedancia en la fuente de alimentación de inducción para compensar el cambio. [13]
Hierro gamma (γ-Fe) [ editar ]
Cuando se calienta el hierro por encima de 912 ° C (1,674 ° F), su estructura cristalina cambia a una estructura cristalina cúbica centrada en la cara (fcc). De esta forma se le llama hierro gamma (γ-Fe) o austenita . El γ-hierro puede disolver considerablemente más carbono (hasta un 2,04% en masa a 1.146 ° C). Esta forma γ de saturación de carbono se presenta en el acero inoxidable .
Hierro delta (δ-Fe) [ editar ]
Curiosamente, por encima de 1.394 ° C (2.541 ° F), el hierro vuelve a la estructura bcc, conocida como δ-Fe. [14] El δ-hierro puede disolver hasta un 0,08% del carbono en masa a 1475 ° C. Es estable hasta su punto de fusión de 1.538 ° C (2.800 ° F).
Alótropos de alta presión [ editar ]
Hierro épsilon / Hexaferrum (ε-Fe) [ editar ]
A presiones superiores a aproximadamente 10 GPa y temperaturas de unos pocos cientos de kelvin o menos, el hierro α cambia a una estructura hexagonal compacta (hcp), que también se conoce como hierro ε o hexaferrum; [15] la fase γ de temperatura más alta también cambia a hierro ε, pero lo hace a una presión más alta. Se ha observado antiferromagnetismo en aleaciones de épsilon-Fe con Mn, Os y Ru. [dieciséis]
Alta temperatura y presión experimentales [ editar ]
Una forma estable alternativa, si existe, puede aparecer a presiones de al menos 50 GPa y temperaturas de al menos 1.500 K; se ha pensado que tiene una estructura hcp ortorrómbica o doble. [1] a diciembre de 2011, se están llevando a cabo experimentos recientes y en curso con alótropos de carbono superdensos y de alta presión .
Transiciones de fase [ editar ]
Puntos de fusión y ebullición [ editar ]
El punto de fusión del hierro está bien definido experimentalmente para presiones inferiores a 50 GPa.
Para presiones mayores, los datos publicados (a partir de 2007) ponen el punto triple γ-ε-líquido a presiones que difieren en decenas de gigapascales y 1000 K en el punto de fusión. En términos generales, las simulaciones informáticas de dinámica molecular de la fusión del hierro y los experimentos de ondas de choque sugieren puntos de fusión más altos y una pendiente mucho más pronunciada de la curva de fusión que los experimentos estáticos llevados a cabo en celdas de yunque de diamante . [17]
Los puntos de fusión y ebullición del hierro, junto con su entalpía de atomización , son más bajos que los de los primeros elementos del grupo 3d, desde el escandio al cromo , lo que muestra la menor contribución de los electrones 3d a la unión metálica a medida que se atraen cada vez más hacia el interior. núcleo inerte por el núcleo; [18] sin embargo, son más altos que los valores del elemento anterior manganeso porque ese elemento tiene una subcapa 3d medio llena y, en consecuencia, sus electrones d no se deslocalizan fácilmente. Esta misma tendencia aparece para el rutenio pero no para el osmio. [19]
Transiciones de fase estructural [ editar ]
Las temperaturas exactas a las que el hierro pasará de una estructura cristalina a otra depende de la cantidad y el tipo de otros elementos que se disuelvan en el hierro. El límite de fase entre las diferentes fases sólidas se dibuja en un diagrama de fase binario , generalmente representado como temperatura versus porcentaje de hierro. La adición de algunos elementos, como el cromo , reduce el rango de temperatura para la fase gamma, mientras que otros aumentan el rango de temperatura de la fase gamma. En los elementos que reducen el rango de la fase gamma, el límite de la fase alfa-gamma se conecta con el límite de la fase gamma-delta, formando lo que generalmente se llama el bucle Gamma . La adición de aditivos de bucle Gamma mantiene el hierro en una estructura cúbica centrada en el cuerpo y evita que el acero sufratransición de fase a otros estados sólidos. [20]
Ver también [ editar ]
- Templado (metalurgia)
Referencias [ editar ]
- ↑ a b Boehler, Reinhard (2000). "Experimentos de alta presión y el diagrama de fase del manto inferior y materiales del núcleo". Reseñas de Geofísica . Unión Geofísica Americana. 38 (2): 221–245. Código Bibliográfico : 2000RvGeo..38..221B . doi : 10.1029 / 1998RG000053 . S2CID 33458168 .
- ^ Cohen, Ronald; Stixrude, Lars. "Cristal en el centro de la tierra" . Archivado desde el original el 5 de febrero de 2007 . Consultado el 5 de febrero de 2007 .
- ^ Stixrude, Lars; Cohen, RE (marzo de 1995). "Elasticidad de alta presión del hierro y anisotropía del núcleo interno de la Tierra". Ciencia . 267 (5206): 1972–5. Código Bibliográfico : 1995Sci ... 267.1972S . doi : 10.1126 / science.267.5206.1972 . PMID 17770110 . S2CID 39711239 .
- ^ "¿Qué hay en el centro de la Tierra?" . BBC News . 31 de agosto de 2011.
- ^ a b Diagramas de fase de aleación . Manual de MAPE. 3 . ASM International. 1992. págs. 2.210, 4.9. ISBN 978-0-87170-381-1.
- ^ DK Bullens et al ., Acero y su tratamiento térmico, vol. Yo, Cuarta Ed. , J. Wiley & Sons Inc., 1938, pág. 86.
- ^ Avner, SH (1974). Introducción a la metalurgia física (2ª ed.). McGraw-Hill. pag. 225. ISBN 978-0-07-002499-1.
- ^ Maranian, Peter (2009), Reducción de fallas frágiles y de fatiga en estructuras de acero , Nueva York: Sociedad Estadounidense de Ingenieros Civiles, ISBN 978-0-7844-1067-7.
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Estructura de acero liso , consultado el 21 de octubre de 2008.
- ^ Alvarenga HD, Van de Putte T, Van Steenberge N, Sietsma J, Terryn H (enero de 2015). "Influencia de la morfología y microestructura del carburo en la cinética de la descarburación superficial de aceros C-Mn". Metall Mater Trans A . 46 (1): 123-133. Código Bib : 2015MMTA ... 46..123A . doi : 10.1007 / s11661-014-2600-y . S2CID 136871961 .
- ^ Smith y Hashemi , 2006 , p. 363.
- ^ Semiatin, SL; Stutz, DE (1986). Tratamiento térmico de inducción del acero . ASM International. págs. 95–98. ISBN 978-0-87170-211-1.
- ^ Lyman, Taylor, ed. (1973). Metalografía, Estructuras y Diagramas de Fases . Manual de metales. 8 (8ª ed.). Metals Park, Ohio: ASM International. OCLC 490375371 .
- ^ Mathon O; Baudelet F; Itié JP; Polian A; d'Astuto M; Chervin JC; Pascarelli S (14 de diciembre de 2004). "Dinámica de la transición de fase alfa-épsilon magnética y estructural en hierro". Cartas de revisión física . 93 (25): 255503. arXiv : cond-mat / 0405439 . Código bibliográfico : 2004PhRvL..93y5503M . doi : 10.1103 / PhysRevLett.93.255503 . PMID 15697906 . S2CID 19228886 .
- ^ GC Fletcher; RP Addis (noviembre de 1974). "El estado magnético de la fase del hierro" (PDF) . Revista de física F: Física de metales . 4 (11). pag. 1954. Código bibliográfico : 1974JPhF .... 4.1951F . doi : 10.1088 / 0305-4608 / 4/11/020 . Consultado el 30 de diciembre de 2011 .
- ^ Boehler, Reinhard; Ross, M. (2007). "Propiedades de las rocas y minerales_ Fusión a alta presión". Física Mineral . Tratado de Geofísica. 2 . Elsevier. págs. 527–41. doi : 10.1016 / B978-044452748-6.00047-X . ISBN 9780444527486.
- ^ Greenwood y Earnshaw, p. 1116
- ^ Greenwood y Earnshaw, págs. 1074–75
- ^ Myer Kurz, ed. (22 de julio de 2002). Manual de selección de materiales . pag. 44. ISBN 9780471359241. Consultado el 19 de diciembre de 2013 .