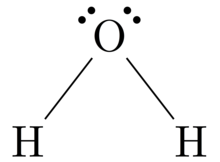
Estructura de Lewis
Estructuras de Lewis , también conocidos como Lewis dot fórmulas, Lewis dot estructuras , electrónica salpican las estructuras , o estructuras de electrones de puntos de Lewis (LED) , son diagramas que muestran la unión entre átomos de un molécula , así como los pares solitarios de electrones que pueden existir en la molécula. [1] [2] [3] Se puede dibujar una estructura de Lewis para cualquier molécula unida covalentemente , así como para compuestos de coordinación . La estructura de Lewis recibió su nombre de Gilbert N. Lewis , quien la presentó en su artículo de 1916.El átomo y la molécula. [4] Las estructuras de Lewis amplían el concepto del diagrama de puntos de electrones al agregar líneas entre átomos para representar pares compartidos en un enlace químico.
Las estructuras de Lewis muestran cada átomo y su posición en la estructura de la molécula usando su símbolo químico. Las líneas se dibujan entre los átomos que están unidos entre sí (se pueden usar pares de puntos en lugar de líneas). Los electrones en exceso que forman pares solitarios se representan como pares de puntos y se colocan junto a los átomos.
Aunque los elementos del grupo principal del segundo período y más allá generalmente reaccionan ganando, perdiendo o compartiendo electrones hasta que han alcanzado una configuración electrónica de capa de valencia con un octeto completo de (8) electrones, el hidrógeno (H) solo puede formar enlaces que comparten solo dos electrones.
El número total de electrones representados en una estructura de Lewis es igual a la suma del número de electrones de valencia en cada átomo individual. Los electrones sin valencia no están representados en las estructuras de Lewis.
Una vez que se ha determinado el número total de electrones disponibles, los electrones deben colocarse en la estructura de acuerdo con estos pasos:
Las estructuras de Lewis para iones poliatómicos se pueden dibujar por el mismo método. Al contar electrones, los iones negativos deben tener electrones adicionales colocados en sus estructuras de Lewis; Los iones positivos deberían tener menos electrones que una molécula sin carga. Cuando se escribe la estructura de Lewis de un ion, toda la estructura se coloca entre corchetes y la carga se escribe como un superíndice en la parte superior derecha, fuera de los corchetes.