Relación de aire y combustible
La relación aire-combustible ( AFR ) es la relación de masa de aire a un combustible sólido, líquido o gaseoso presente en un proceso de combustión . La combustión puede tener lugar de manera controlada, como en un motor de combustión interna o un horno industrial, o puede resultar en una explosión (por ejemplo, una explosión de polvo, una explosión de gas o vapor o en un arma termobárica ).
La relación aire-combustible determina si una mezcla es combustible, cuánta energía se libera y cuántos contaminantes no deseados se producen en la reacción. Por lo general, existe un rango de relaciones de combustible a aire, fuera del cual no se producirá la ignición. Estos se conocen como límites explosivos inferior y superior.
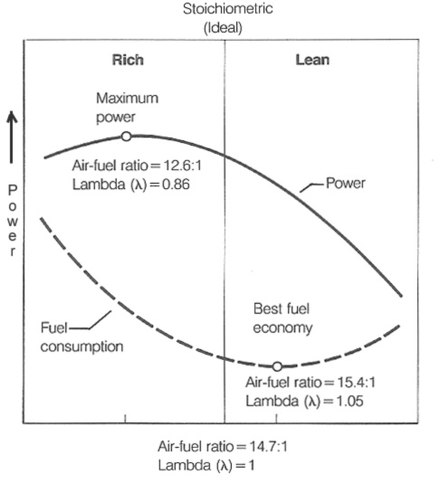
En un motor de combustión interna o en un horno industrial, la relación aire-combustible es una medida importante por razones de anticontaminación y ajuste del rendimiento. Si se proporciona exactamente suficiente aire para quemar completamente todo el combustible, la relación se conoce como mezcla estequiométrica , a menudo abreviada como stoich . Las relaciones inferiores a la estequiométrica se consideran "ricas". Las mezclas ricas son menos eficientes, pero pueden producir más energía y quemarse a menor temperatura. Las relaciones superiores a las estequiométricas se consideran "magras". Las mezclas pobres son más eficientes pero pueden causar temperaturas más altas, lo que puede conducir a la formación de óxidos de nitrógeno . Algunos motores están diseñados con características que permiten la mezcla pobre . Para cálculos precisos de la relación aire-combustible, elEl contenido de oxígeno del aire de combustión debe especificarse debido a la diferente densidad del aire debido a la diferente altitud o temperatura del aire de admisión, posible dilución por vapor de agua ambiental o enriquecimiento por adición de oxígeno.
En teoría, una mezcla estequiométrica tiene suficiente aire para quemar completamente el combustible disponible. En la práctica, esto nunca se logra del todo, debido principalmente al muy corto tiempo disponible en un motor de combustión interna para cada ciclo de combustión. La mayor parte del proceso de combustión se completa en aproximadamente 2 milisegundos a una velocidad del motor de6.000 revoluciones por minuto . (100 revoluciones por segundo; 10 milisegundos por revolución del cigüeñal, lo que para un motor de cuatro tiempos significaría normalmente 5 milisegundos por cada carrera del pistón). Este es el tiempo que transcurre desde que se enciende la bujía hasta que se quema el 90% de la mezcla de combustible y aire, generalmente unos 80 grados de rotación del cigüeñal más tarde. Los convertidores catalíticos están diseñados para funcionar mejor cuando los gases de escape que los atraviesan son el resultado de una combustión casi perfecta.
Una mezcla perfectamente estequiométrica se quema muy caliente y puede dañar los componentes del motor si el motor se somete a una carga alta en esta mezcla de aire y combustible. Debido a las altas temperaturas en esta mezcla, la detonación de la mezcla de aire y combustible mientras se acerca o poco después de la presión máxima del cilindro es posible bajo una carga alta (lo que se conoce como detonación ).o ping), específicamente un evento de "pre-detonación" en el contexto de un modelo de motor de encendido por chispa. Tal detonación puede causar daños graves al motor, ya que la quema descontrolada de la mezcla de aire y combustible puede crear presiones muy altas en el cilindro. Como consecuencia, las mezclas estequiométricas solo se utilizan en condiciones de carga ligera a baja-moderada. Para condiciones de aceleración y alta carga, se usa una mezcla más rica (relación aire-combustible más baja) para producir productos de combustión más fríos (utilizando así enfriamiento por evaporación ), y así evitar el sobrecalentamiento de la culata y así prevenir la detonación.
La mezcla estequiométrica para un motor de gasolina es la proporción ideal de aire a combustible que quema todo el combustible sin exceso de aire. Para el combustible de gasolina , la mezcla aire-combustible estequiométrica es de aproximadamente 14,7:1 [1], es decir, por cada gramo de combustible, se requieren 14,7 gramos de aire. Para combustible de octano puro , la reacción de oxidación es: