Reordenamiento 2,3-Wittig
La transposición [2,3] -Wittig es la transformación de un éter alílico en un alcohol homoalílico mediante un proceso pericíclico concertado . Debido a que la reacción es concertada, exhibe un alto grado de estereocontrol y puede emplearse al principio de una ruta sintética para establecer la estereoquímica. Sin embargo, el reordenamiento de Wittig requiere condiciones muy básicas, ya que un intermedio de carbanión es esencial. [1,2] -La reordenación de Wittig es un proceso competitivo. [1]
Introducción
[2, 3] - Los reordenamientos sigmatrópicos ocurren para una variedad de grupos X e Y (ver más abajo). Cuando X es un carbanión e Y un alcóxido , la transposición se denomina transposición [2,3] -Wittig y los productos son pent-1-en-5-oles. La transposición [1,2] -Wittig, que produce pent-5-en-1-oles isoméricos , es un proceso competitivo que tiene lugar a altas temperaturas. [2] Debido a la alta economía de átomos y la estereoselectividad del reordenamiento [2,3], ha ganado una considerable utilidad sintética. El carbanión se genera por litiación directa de sustratos moderadamente ácidos, transmetalación de estaño, o litiación reductora de O, S-acetales. Se han utilizado métodos estereoselectivos que emplean materiales de partida quirales para efectuar una inducción asimétrica o una diastereoselección simple [3].
(1)

Mecanismo y estereoquímica
Mecanismo predominante
Después de la formación del carbanión, el reordenamiento [2,3] -Wittig es rápido y selectivo a bajas temperaturas. Sin embargo, si se deja que la mezcla de reacción alcance temperaturas superiores a -60 ° C, la reordenación [1,2] se vuelve competitiva. [4]
(2)

El estado de transición postulado posee una estructura envolvente de cinco miembros. [5] El grupo adherido al carbanión (G) puede ocupar una posición pseudoecuatorial o pseudoaxial, aunque generalmente se prefiere la primera. Los sustituyentes grandes en el otro lado del oxígeno del éter prefieren ocupar la posición exo (R E ) para evitar la cepa A 1,3 . Estas restricciones conducen a una preferencia por el producto syn de los isómeros ( Z ) y los productos anti de los isómeros ( E ); sin embargo, se conocen algunas excepciones a esta regla. [6]
(3)

Variantes estereoselectivas
Las variantes estereoselectivas del reordenamiento [2,3] -Wittig han empleado tres estrategias: diastereoselección basada en un estereocentro existente establecido, colocación de un auxiliar quiral en el material de partida cuya configuración no se ve afectada por la reacción y el uso de una base quiral . La estrategia de diastereoselección relativa funciona bien solo para un número limitado de grupos G, pero generalmente da como resultado altos rendimientos porque no es necesario eliminar ni modificar ningún grupo auxiliar quiral. El estereocentro opuesto al carbanión generalmente debe ser terciario (en lugar de cuaternario) para hacer cumplir la colocación del sustituyente más grande en la posición RE . [7]
(4)
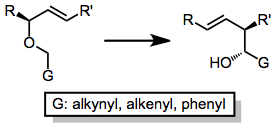
El enfoque de inducción asimétrica se basa en estereocentros ya establecidos en el material de partida que no se ven afectados por la reacción (auxiliares quirales). El mayor éxito se ha logrado colocando estos estereocentros en el grupo G [8] o en un sustituyente unido al final del doble enlace. [9] Las proporciones diastereoméricas superiores a 90:10 son comunes para estas reacciones; sin embargo, la eliminación del auxiliar quiral a veces es difícil. [10]
(5)

El uso de bases quirales ha proporcionado productos de transposición enriquecidos enantioen algunos casos, [11] aunque este método no parece ser general. La enantioselectividad en estas reacciones suele ser baja, lo que sugiere que la asociación entre el ácido conjugado de la base y el carbanión reordenado es probablemente débil.
(6)
Alcance y limitaciones
Una variedad de éteres alílicos se someten a la transposición de Wittig; el requisito fundamental es la capacidad de generar el carbanión apropiado en el sustrato. Esto exige hidrógenos ácidos, un grupo funcional reducible o un enlace carbono-metal. Históricamente, se han utilizado grupos alquenilo , alquinilo y fenilo para acidificar la posición α. Se toleran los alquinos terminales libres, aunque los rendimientos son mayores cuando se utilizan alquinos protegidos con sililo. [12]
(7)
Cuando se usa un alqueno como grupo estabilizador de aniones G, surgen problemas de selectividad con respecto al sitio del carbanión. Los grupos estabilizadores de aniones tales como (trimetil) sililo o metiltio proporcionan una selectividad de sitio esencialmente completa. [13]
(8)
También se pueden usar grupos carbonilo como grupo estabilizador de aniones; Los grupos carbonilo son particularmente útiles para transposiciones asimétricas que emplean auxiliares quirales. [14]
(9)
Un método altamente enantioselectivo que emplea complejos de carbonilo de cromo implica el uso del anillo de fenilo acidificado como grupo estabilizador de aniones. [15]
(10)
El hecho de que el sustrato debe contener hidrógenos ácidos adyacentes al oxígeno del éter fue una limitación significativa de la reacción original. Así, el desarrollo de métodos de transmetalación que permitieron la generación selectiva de carbaniones a partir de enlaces carbono-estaño representó un profundo avance metodológico. Como resultado, el alcance de los grupos que podrían unirse al centro aniónico se expandió dramáticamente. [6]
(11)
Aplicaciones sintéticas
Los productos de la transposición [2,3] -Wittig de los éteres bis (alílicos) son 1,5-dien-3-oles. Estos sustratos pueden sufrir la transposición de oxi-Cope tras la desprotonación , proporcionando carbonilos δ, ε-insaturados. Esta estrategia sigmatrópica en tándem se ha empleado en la síntesis de algunos productos naturales, incluidos la brevicomina y el oxocrinol. [dieciséis]
(12)
Variaciones
Una variación del reordenamiento 2,3-Wittig es el reordenamiento Wittig-Still [17]
Condiciones y procedimiento experimentales
Condiciones típicas
Los reordenamientos deben llevarse a cabo a temperaturas inferiores a -60 ° C para evitar un reordenamiento competitivo [1,2]. Típicamente, el simple tratamiento del sustrato con n- butillitio es suficiente para provocar el reordenamiento. Las reacciones que involucren butillitio deben llevarse a cabo bajo nitrógeno o argón con estricta exclusión de agua.
Ver también
- Reordenamiento de sonrisas
Referencias
- ↑ Nakai, T .; Mikami, K. (2004). "El reordenamiento [2,3] -Wittig". Reacciones orgánicas . doi : 10.1002 / 0471264180.or046.02 . ISBN 0471264180.
- ^ Baldwin, JE; Patrick, JE (1971). "Estereoquímica de reacciones [2,3] -sigmatrópicas. Reordenamiento de Wittig". Mermelada. Chem. Soc . 93 (14): 3556. doi : 10.1021 / ja00743a060 .
- ↑ Nakai, T .; Mikami, K .; Taya, S .; Fujita, Y. (1981). "Reordenamiento [2,3] -Wittig de éteres bis-alílicos asimétricos. Método fácil para la síntesis regio- y estereoselectiva de 1,5-dien-3-oles". Mermelada. Chem. Soc . 103 (21): 6492. doi : 10.1021 / ja00411a038 .
- ^ Schollkopf, U .; Fellenberger, K .; Rizk, M. (1970). "1.2-Wanderungen zum Atom mit freiem Elektronenpaar, VIII.ortho-Isomerisation bei anionisierten Äthern und Wanderungsmechanismus eines Propargyl-Restes bei der Wittig-Umlagerung". Justus Liebigs Ann. Chem . 734 : 106-115. doi : 10.1002 / jlac.19707340111 .
- ^ Mikami, K .; Kimura, Y .; Kishi, N .; Nakai, T. (1983). "Diaestereoselección acíclica de la reordenación sigmatrópica [2,3] -Wittig de una serie de éteres crotílicos isoméricos. Un modelo conceptual para la geometría del estado de transición". J. Org. Chem . 48 (2): 279. doi : 10.1021 / jo00150a033 .
- ^ a b Todavía, WC; Mitra, A. (1978). "Una síntesis altamente estereoselectiva de olefinas trisustituidas en Z mediante reordenamiento [2,3] -sigmatrópico. Preferencia por un estado de transición pseudoaxialmente sustituido". Mermelada. Chem. Soc . 100 (6): 1927. doi : 10.1021 / ja00474a049 .
- ^ Sayo, N .; Azuma, K .; Mikami, K .; Nakai, T. (1984). "Estereocontrol acíclico mediante transposición asimétrica de [2,3] -Wittig con alta enantio y eritro-selectividad y su uso en la síntesis quiral de feromonas de insectos". Tetrahedron Lett . 25 (5): 565. doi : 10.1016 / S0040-4039 (00) 99939-8 .
- ^ Mikami, K .; Fujimoto, K .; Kyosuke, T .; Nakai, T. (1984). "Asimétrico [2,3] reordenamiento sigmatrópico de Wittig que implica un azaenolato quiral como el terminal migratorio. Una síntesis simple de (+) - verrucarinolactona". Tetrahedron Lett . 25 (52): 6011. doi : 10.1016 / S0040-4039 (01) 81746-9 .
- ^ Priepke, H .; Bruckner, R .; Harms, K. (1990). "Inducción asimétrica en el reordenamiento de Wittig-Still de éteres que contienen un estereocentro alílico - Diastereocontrol por nitrógeno alílico". Chem. Ber . 123 (3): 555. doi : 10.1002 / cber.19901230323 .
- ^ Paquette, LA; Wright, J .; Drtina, GJ; Roberts, RA (1987). "Síntesis total enantioespecífica de ácido (-) - retigeranic natural ay dos candidatos (-) - ácido retigeranic B". J. Org. Chem . 52 (13): 2960. doi : 10.1021 / jo00389a070 .
- ^ Marshall, JA; Lebreton, J. (1988). "Síntesis enantioselectiva de alcoholes propargílicos macrocíclicos por contracción del anillo [2,3] Wittig. Síntesis de (+) - aristolactona y precursores cembranoides". Mermelada. Chem. Soc . 110 (9): 2925. doi : 10.1021 / ja00217a039 .
- ↑ Castedo, L .; Granja, JR; Mourino, A. (1985). "(2,3) -Wittig reordenamientos sigmatrópicos en la síntesis de esteroides. Nuevo enfoque estereocontrolado de las cadenas laterales de esteroides en C-20". Tetrahedron Lett . 26 (40): 4959. doi : 10.1016 / S0040-4039 (00) 94997-9 .
- ^ Mikami, K .; Kishi, N .; Nakai, T. (1989). "Regiocontrol dirigido por silicio en reordenamientos de Witting de bis-alil éteres y alil propargil éteres". Chem. Lett . 18 (9): 1683–1686. doi : 10.1246 / cl.1989.1683 .
- ↑ Takahashi, O .; Mikami, K .; Nakai, T. (1987). "Reordenamiento asimétrico de [2,3] -Wittig que implica un extremo enolato de éster quiral. Una síntesis quiral de derivados del ácido eritro-.ALPHA.-hidroxi-.BETA.-alquil carboxílico" . Chem. Lett . 16 (1): 69–72. doi : 10.1246 / cl.1987.69 .
- ↑ Uemura, M .; Nishimura, H .; Minami, T .; Hayashi, Y. (1991). "Complejos de cromo (.eta.6-areno) en síntesis orgánica: Síntesis de (. + -.) - ácido dihidroxiserrulático". Mermelada. Chem. Soc . 113 (14): 5402. doi : 10.1021 / ja00014a036 .
- ^ Mikami, K .; Nakai, T. (1982). “Aplicaciones del reordenamiento en tándem (2,3)-Wittig-oxi-Cope a síntesis de exo-brevicomina y oxocrinol. El alcance y limitación de las secuencias sigmatrópicas como método sintético para cetonas δ, ε-insaturadas”. Chem. Lett . 11 (9): 1349-1352. doi : 10.1246 / cl.1982.1349 .
- ↑ Rycek Lukas, Hudlicky Tomas (2017). "Aplicaciones del reordenamiento de Wittig-Still en síntesis orgánica". Angewandte Chemie International Edition . 56 (22): 6022–6066. doi : 10.1002 / anie.201611329 . PMID 28211171 .
- Reacciones de nombres
- Reacciones de reordenamiento
- Reacciones químicas de los éteres