transición de electrones atómicos
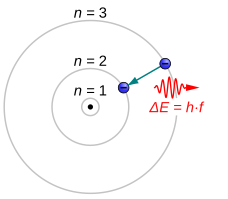
La transición de electrones atómicos es un cambio (o salto) de un electrón de un nivel de energía a otro dentro de un átomo [1] o átomo artificial . [2] Parece discontinuo cuando el electrón "salta" de un nivel de energía cuantificado a otro, normalmente en unos pocos nanosegundos o menos. También se conoce como ( des)excitación electrónica , transición atómica o salto cuántico .
Las transiciones de electrones provocan la emisión o absorción de radiación electromagnética en forma de unidades cuantificadas llamadas fotones . Sus estadísticas son poissonianas y el tiempo entre saltos se distribuye exponencialmente . [3] La constante de tiempo de amortiguamiento (que varía de nanosegundos a unos pocos segundos) se relaciona con la ampliación natural, de presión y de campo de las líneas espectrales . Cuanto mayor sea la separación de energía de los estados entre los que salta el electrón, menor será la longitud de onda del fotón emitido. [4]
El físico danés Niels Bohr primero teorizó que los electrones pueden realizar saltos cuánticos en 1913. [5] Poco después, James Franck y Gustav Ludwig Hertz probaron experimentalmente que los átomos tienen estados de energía cuantizados. [6]
Hans Dehmelt predijo la observabilidad de los saltos cuánticos en 1975, y se observaron por primera vez utilizando iones de mercurio atrapados en el NIST en 1986. [4]
En 2019, se demostró en un experimento con un átomo artificial superconductor que consiste en dos qubits transmon fuertemente hibridados colocados dentro de una cavidad de resonador de lectura a 15 mK, que la evolución de algunos saltos es continua, coherente, determinista y reversible. [7] Por otro lado, otros saltos cuánticos son inherentemente impredecibles. [8]