Estructura de la banda electrónica
En física del estado sólido , la estructura de bandas electrónicas (o simplemente estructura de bandas ) de un sólido describe el rango de niveles de energía que los electrones pueden tener dentro de él, así como los rangos de energía que pueden no tener (llamados intervalos de banda o bandas prohibidas ). bandas ).
La teoría de bandas deriva estas bandas y brechas de banda al examinar las funciones de onda de la mecánica cuántica permitidas para un electrón en una gran red periódica de átomos o moléculas. La teoría de bandas se ha utilizado con éxito para explicar muchas propiedades físicas de los sólidos, como la resistividad eléctrica y la absorción óptica , y constituye la base de la comprensión de todos los dispositivos de estado sólido (transistores, células solares, etc.).
Los electrones de un solo átomo aislado ocupan orbitales atómicos, cada uno de los cuales tiene un nivel de energía discreto . Cuando dos o más átomos se unen para formar una molécula , sus orbitales atómicos se superponen e hibridan . [1] [2]
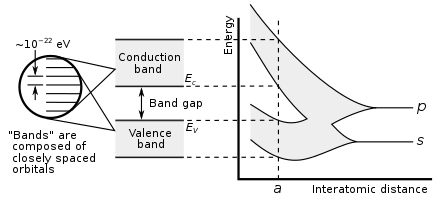
De manera similar, si un gran número N de átomos idénticos se unen para formar un sólido, como una red cristalina , los orbitales atómicos de los átomos se superponen con los orbitales cercanos. [1] Cada nivel de energía discreto se divide en N niveles, cada uno con una energía diferente. Dado que el número de átomos en una pieza macroscópica de sólido es un número muy grande (N~10 22 ), el número de orbitales es muy grande y, por lo tanto, están muy próximos en energía (del orden de 10 −22 eV). La energía de los niveles adyacentes está tan cerca que se pueden considerar como un continuo, una banda de energía.
Esta formación de bandas es principalmente una característica de los electrones más externos ( electrones de valencia ) en el átomo, que son los que participan en el enlace químico y la conductividad eléctrica . Los orbitales electrónicos internos no se superponen en un grado significativo, por lo que sus bandas son muy estrechas.
Las brechas de banda son esencialmente rangos sobrantes de energía que no están cubiertos por ninguna banda, como resultado de los anchos finitos de las bandas de energía. Las bandas tienen diferentes anchos, y los anchos dependen del grado de superposición en los orbitales atómicos de los que surgen. Es posible que dos bandas adyacentes simplemente no sean lo suficientemente anchas para cubrir completamente el rango de energía. Por ejemplo, las bandas asociadas con los orbitales centrales (como los electrones 1s ) son extremadamente estrechas debido a la pequeña superposición entre los átomos adyacentes. Como resultado, tiende a haber grandes intervalos de banda entre las bandas del núcleo. Las bandas más altas involucran orbitales comparativamente más grandes con más superposición, volviéndose progresivamente más anchas a energías más altas para que no haya brechas de banda a energías más altas.