Desoxigenación de Barton-McCombie
| Desoxigenación de Barton-McCombie | |
|---|---|
| Lleva el nombre de | Derek Harold Richard Barton Stuart W. McCombie |
| Tipo de reacción | Reacción redox orgánica |
| Identificadores | |
| Portal de química orgánica | reacción de barton-mccombie |
| ID de ontología RSC | RXNO: 0000134 |
La desoxigenación de Barton-McCombie es una reacción orgánica en la que un grupo funcional hidroxi en un compuesto orgánico se reemplaza por un hidrógeno para dar un grupo alquilo . [1] [2] Lleva el nombre de los químicos británicos Sir Derek Harold Richard Barton (1918-1998) y Stuart W. McCombie.
Esta reacción de desoxigenación es una sustitución radical . En la descarboxilación de Barton relacionada, el reactivo es un ácido carboxílico .
Mecanismo
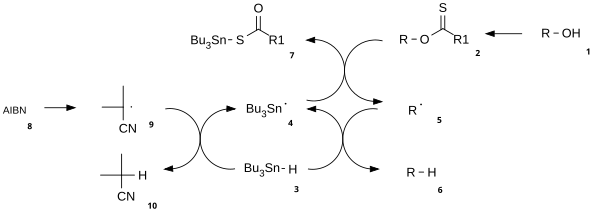
El mecanismo de reacción consta de una etapa de iniciación de radicales catalíticos y una etapa de propagación. [3] El alcohol ( 1 ) se convierte primero en un intermedio de carbonotioilo reactivo, como un tionoéster o xantato 2 . El calentamiento de AIBN da como resultado su escisión homolítica, generando dos radicales 2-cianoprop-2-ilo 9, cada uno de los cuales extrae un protón del tributilestannilo 3 para generar radicales tributilestannilo 4 e inactivo 10 . El radical tributilestaño extrae el grupo xantato de 2 mediante el ataque de4 en el átomo de azufre con escisión homolítica concurrente del enlace π CS. Esto deja un radical centrado en carbono que forma un enlace CO π a través de la escisión homolítica del enlace RO σ, dando el radical alquilo 5 y el xantato de tributilestaño 7 . El enlace azufre- estaño en este compuesto es muy estable y proporciona la fuerza impulsora para esta reacción. A continuación, el radical alquilo 5 extrae un átomo de hidrógeno de una nueva molécula de tributilestanano generando el producto desoxigenado deseado ( 6 ) y una nueva especie de radical lista para la propagación.
Variaciones
Fuentes de hidrógeno alternativas
La principal desventaja de esta reacción es el uso de tributilestannano que es tóxico, caro y difícil de eliminar de la mezcla de reacción. Una alternativa es el uso de óxido de tributilestaño como fuente de radicales y poli (metilhidridesiloxano) (PMHS) como fuente de hidrógeno . [4] El clorotionoformiato de fenilo utilizado como material de partida genera finalmente sulfuro de carbonilo .
Trialquil boranos
Un donante de hidrógeno aún más conveniente lo proporcionan los complejos de trialquilborano- agua [5] como el trimetilborano contaminado con pequeñas cantidades de agua.
En este ciclo catalítico, la reacción se inicia por oxidación con aire del trialquilborano 3 por aire al radical metilo 4 . Este radical reacciona con el xantato 2 para dar S-metil-S-metil ditiocarbonato 7 y el radical intermedio 5 . El complejo 3 (CH 3 ) 3 B.H 2 O proporciona un hidrógeno para recombinarse con este radical en el alcano 6 dejando atrás ácido dietil borínico y un nuevo radical metilo.
Se encuentra mediante cálculos teóricos que una reacción de homólisis de OH en el complejo borano-agua es endotérmica con una energía similar a la de la reacción de homólisis en tributilestannano pero mucho más baja que la reacción de homólisis del agua pura.
Alcance
Se utilizó una variación de esta reacción como uno de los pasos en la síntesis total de azadiractina : [6]
En otra variación, el reactivo es el imidazol 1,1'-tiocarbonildiimidazol (TCDI), por ejemplo en la síntesis total de palescensina B. [7] El TCDI es especialmente bueno para los alcoholes primarios porque no hay estabilización por resonancia del xantato debido a que el nitrógeno lonepair participa en el sexteto aromático.
La reacción también se aplica a los S- alquilxantatos. Con trietilborano como nuevo reactivo libre de metales, los átomos de hidrógeno requeridos se extraen de los disolventes próticos, la pared del reactor o incluso (en condiciones estrictamente anhidras) el propio borano. [8]
Ver también
- Eliminación de Chugaev
Referencias
- ^ Barton, DHR ; McCombie, SW (1975). "Un nuevo método para la desoxigenación de alcoholes secundarios". J. Chem. Soc., Perkin Trans. 1 . 16 (16): 1574-1585. doi : 10.1039 / P19750001574 .
- ^ Crich, D .; Quintero, L. (1989). "Química radical asociada al grupo tiocarbonilo". Chem. Rev. 89 (7): 1413–1432. doi : 10.1021 / cr00097a001 .
- ^ Forbes, JE; Zard, SZ (enero de 1989). "Una nueva reacción en cadena de radicales de anhídridos xánticos. Observaciones adicionales sobre la intermediación de radicales alcoxi-tiocarbonilo en la reacción de Barton-McCombie". Letras de tetraedro . 30 (33): 4367–4370. doi : 10.1016 / s0040-4039 (00) 99362-6 .
- ↑ Tormo, J .; Fu, GC (2002). "α-D-Ribo-hexofuranosa, 3-desoxi-1,2: 5,6-bis-O- (1-metiletilideno)". Org. Synth . 78 : 239. doi : 10.15227 / orgsyn.078.0239 .
- ^ Desoxigenación de alcoholes que emplean agua como fuente del átomo de hidrógeno David A. Spiegel, Kenneth B. Wiberg , Laura N. Schacherer, Matthew R. Medeiros y John L. Wood J. Am. Chem. Soc. 2005 , 127 , 12513-12515. ( doi : 10.1021 / ja052185l )
- ^ Síntesis de Azadirachtin: un viaje largo pero exitoso Gemma E. Veitch, Edith Beckmann, Brenda J. Burke, Alistair Boyer, Sarah L. Maslen y Steven V. Ley Angew. Chem. En t. Ed. 2007 , doi : 10.1002 / anie.200703027
- ^ La primera síntesis total de (±) -pallescensin B Wen-Cheng Liu y Chun-Chen Liao Chem. Comun. , 1999 , 117–118 117 Artículo
- ^ Parte 2. Aspectos mecanicistas de la reducción de S -alquil-tionocarbonatos en presencia de trietilborano y aire Allais F, Boivin J, Nguyen V Beilstein J. Org. Chem. , 2007 3:45 (12 de diciembre de 2007) doi : 10.1186 / 1860-5397-3-46
enlaces externos
- Barton-McCombie @ organic-chemistry.org
- Artículo de noticias de química e ingeniería sobre la reacción de alquilborano
- Reacciones redox orgánicas
- Reacciones de radicales libres
- Reacciones de nombres