celula daniel
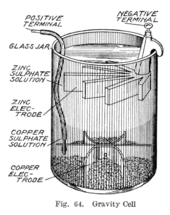
La celda de Daniell es un tipo de celda electroquímica inventada en 1836 por John Frederic Daniell , un químico y meteorólogo británico , y consiste en una olla de cobre llena de una solución de sulfato de cobre (II) , en la que se sumerge un recipiente de barro sin esmaltar lleno de sulfúrico . ácido y un electrodo de zinc. Estaba buscando una manera de eliminar el problema de la burbuja de hidrógeno que se encuentra en la pila voltaica , y su solución fue usar un segundo electrolito para consumir el hidrógeno producido por el primero. Sulfato de cincpuede ser sustituido por el ácido sulfúrico. La celda Daniell fue una gran mejora con respecto a la tecnología existente utilizada en los primeros días del desarrollo de la batería . Una variante posterior de la celda de Daniell llamada celda de gravedad o celda de pata de gallo fue inventada en la década de 1860 por un francés llamado Callaud y se convirtió en una opción popular para la telegrafía eléctrica .
La celda de Daniell es también la base histórica para la definición contemporánea del voltio , que es la unidad de fuerza electromotriz en el Sistema Internacional de Unidades . Las definiciones de unidades eléctricas que se propusieron en la Conferencia Internacional de Electricistas de 1881 se diseñaron de modo que la fuerza electromotriz de la celda de Daniell fuera de aproximadamente 1,0 voltios. [1] [2] Con definiciones contemporáneas, el potencial estándar de la celda de Daniell a 25 °C es en realidad 1,10 V. [3]
En la celda de Daniell, los electrodos de cobre y zinc se sumergen en una solución de sulfato de cobre (II) y sulfato de zinc , respectivamente. En el ánodo (electrodo negativo), el zinc se oxida según la siguiente semirreacción:
Tenga en cuenta que los iones de cobre cargados positivamente se mueven hacia el electrodo positivo, impulsados por una reducción de la energía química.
Estos procesos dan como resultado la acumulación de cobre sólido en el cátodo y la corrosión del electrodo de zinc en la solución como cationes de zinc. La celda de Daniell produce aproximadamente 213 kJ por mol (65 g) de zinc. Esta energía se puede atribuir principalmente a la unión más débil de 207 kJ/mol (menor magnitud de la energía cohesiva) en el zinc en comparación con el cobre metálico, lo que se puede explicar en términos de la falta de unión a través de orbitales d parcialmente llenos en zinc. [6]
En las demostraciones en el aula, a menudo se usa una forma de celda de Daniell conocida como dos medias celdas debido a su simplicidad. Las dos medias celdas soportan cada una la mitad de las reacciones descritas anteriormente. Un cable y una bombilla pueden conectar los dos electrodos. Los electrones en exceso producidos por la oxidación del zinc metálico son "empujados" fuera del ánodo, que por lo tanto es el electrodo negativo, viajan a través del cable y son "jalados" hacia el cátodo de cobre donde son consumidos por la reducción de iones de cobre. Esto proporciona una corriente eléctrica que ilumina la bombilla.