La electrólisis del agua es el proceso de utilizar electricidad para descomponer el agua en oxígeno e hidrógeno . El gas hidrógeno liberado de esta manera puede usarse como combustible de hidrógeno , o mezclarse nuevamente con el oxígeno para creargas oxhídrico , que se usa en soldadura y otras aplicaciones.
A veces llamada división de agua , la electrólisis requiere una diferencia de potencial mínima de 1,23 voltios .
Historia [ editar ]
Jan Rudolph Deiman y Adriaan Paets van Troostwijk utilizaron, en 1789, una máquina electrostática para producir electricidad que se descargaba sobre electrodos de oro en una jarra de Leyden con agua. [1] En 1800, Alessandro Volta inventó la pila voltaica , y unas semanas más tarde los científicos ingleses William Nicholson y Anthony Carlisle la utilizaron para la electrólisis del agua. En 1806, Humphry Davy informó los resultados de extensos experimentos de electrólisis de agua destilada, concluyendo que el ácido nítricose produjo en el ánodo a partir de gas nitrógeno atmosférico disuelto. Usó una batería de alto voltaje y electrodos y recipientes no reactivos, como conos de electrodo de oro, que se doblaban como recipientes con puentes de amianto húmedo. [2] Cuando Zénobe Gramme inventó la máquina Gramme en 1869, la electrólisis del agua se convirtió en un método barato para la producción de hidrógeno. Dmitry Lachinov desarrolló un método de síntesis industrial de hidrógeno y oxígeno mediante electrólisis en 1888. [3]
Principio [ editar ]
Una fuente de energía eléctrica de CC está conectada a dos electrodos o dos placas (generalmente hechas de algún metal inerte como platino o iridio ) que se colocan en el agua. El hidrógeno aparecerá en el cátodo (donde los electrones entran al agua) y el oxígeno aparecerá en el ánodo . [4] Suponiendo una eficiencia faradaica ideal , la cantidad de hidrógeno generado es el doble de la cantidad de oxígeno, y ambos son proporcionales a la carga eléctrica total conducida por la solución. [5] Sin embargo, en muchas células las reacciones secundarias que compitenocurren, dando como resultado diferentes productos y una eficiencia faradaica inferior a la ideal.
La electrólisis del agua pura requiere un exceso de energía en forma de sobrepotencial para superar varias barreras de activación. Sin el exceso de energía, la electrólisis del agua pura se produce muy lentamente o no ocurre en absoluto. Esto se debe en parte a la limitada autoionización del agua . El agua pura tiene una conductividad eléctrica de una millonésima parte de la del agua de mar. Muchas celdas electrolíticas también pueden carecer de los electrocatalizadores necesarios . La eficiencia de la electrólisis aumenta mediante la adición de un electrolito (como una sal , un ácido o una base) y el uso de electrocatalizadores .
Actualmente, el proceso electrolítico rara vez se usa en aplicaciones industriales, ya que actualmente el hidrógeno se puede producir de manera más asequible a partir de combustibles fósiles . [6]
Ecuaciones [ editar ]
En agua pura en el cátodo cargado negativamente, tiene lugar una reacción de reducción , con electrones (e - ) del cátodo que se dan a los cationes de hidrógeno para formar gas hidrógeno. La media reacción , equilibrada con ácido, es:
- Reducción en el cátodo: 2 H + ( aq ) + 2e - → H 2 ( g )
En el ánodo cargado positivamente, se produce una reacción de oxidación , generando gas oxígeno y dando electrones al ánodo para completar el circuito:
- Oxidación en el ánodo: 2 H 2 O ( l ) → O 2 ( g ) + 4 H + ( aq ) + 4e -
Las mismas semirreacciones también se pueden equilibrar con la base como se indica a continuación. No todas las semirreacciones deben equilibrarse con ácido o base. Muchos lo hacen, como la oxidación o reducción del agua que se enumeran aquí. Para agregar semirreacciones, ambas deben equilibrarse con ácido o base. Las reacciones equilibradas con ácido predominan en soluciones ácidas (pH bajo), mientras que las reacciones equilibradas con bases predominan en soluciones básicas (pH alto).
| Cátodo (reducción): | 2 H 2 O ( l ) + 2e - | → | H 2 ( g ) + 2 OH - ( aq ) |
| Ánodo (oxidación): | 2 OH - ( aq ) | → | 1/2 O 2 ( g ) + H 2 O ( l ) + 2 e - |
La combinación de cualquiera de las dos medias reacciones produce la misma descomposición general de agua en oxígeno e hidrógeno:
- Reacción general: 2 H 2 O ( l ) → 2 H 2 ( g ) + O 2 ( g )
El número de moléculas de hidrógeno producidas es, por tanto, el doble del número de moléculas de oxígeno. Suponiendo la misma temperatura y presión para ambos gases, el gas hidrógeno producido tiene, por tanto, el doble del volumen del gas oxígeno producido. El número de electrones empujados a través del agua es el doble del número de moléculas de hidrógeno generadas y cuatro veces el número de moléculas de oxígeno generadas.
Termodinámica [ editar ]
La descomposición del agua pura en hidrógeno y oxígeno a temperatura y presión estándar no es favorable en términos termodinámicos .
| Ánodo (oxidación): | 2 H 2 O ( l ) | → | O 2 ( g ) + 4 H + ( aq ) + 4e - | E o = +1,23 V (para la semiecuación de reducción) [7] | |
| Cátodo (reducción): | 2 H + ( aq ) + 2e - | → | H 2 ( g ) | E o = 0,00 V |
Así, el potencial estándar de la célula de electrólisis del agua (E o célula = E o cátodo - E o ánodo ) es -1,229 V a 25 ° C a pH 0 ([H + ] = 1,0 M). A 25 ° C con pH 7 ([H + ] = 1.0 × 10 −7 M), el potencial no cambia según la ecuación de Nernst . El potencial de celda estándar termodinámico se puede obtener a partir de cálculos de energía libre de estado estándar para encontrar ΔG ° y luego usar la ecuación: ΔG ° = −n FE ° (donde E ° es el potencial de celda y F la constante de Faraday, es decir, 96.485,3321233 C / mol). Para dos moléculas de agua electrolizadas y, por tanto, dos moléculas de hidrógeno formadas, n = 4 y ΔG ° = 474.48 kJ / 2 mol (agua) = 237.24 kJ / mol (agua), y ΔS ° = 163 J / K mol (agua), y? H ° = 571,66 kJ / mol 2 (agua) = 285,83 kJ / mol (agua), y finalmente 141,86 MJ / kg (H 2 ). Sin embargo, los cálculos con respecto a los potenciales de equilibrio de los electrodos individuales requieren algunas correcciones teniendo en cuenta los coeficientes de actividad. [8]En la práctica, cuando una celda electroquímica se "impulsa" hasta su finalización aplicando un potencial razonable, se controla cinéticamente. Por lo tanto, la energía de activación, la movilidad de iones (difusión) y la concentración, la resistencia del cable, el impedimento de la superficie, incluida la formación de burbujas (que causa el bloqueo del área del electrodo) y la entropía, requieren un mayor potencial aplicado para superar estos factores. La cantidad de aumento de potencial requerido se denomina sobrepotencial .
Selección de electrolitos [ editar ]
Si los procesos descritos anteriormente ocurren en agua pura, los cationes H + se consumirán / reducirán en el cátodo y los aniones OH - se consumirán / oxidarán en el ánodo. Esto se puede verificar agregando un indicador de pH al agua: el agua cerca del cátodo es básica mientras que el agua cerca del ánodo es ácida. Los iones de hidróxido negativos que se acercan al ánodo se combinan principalmente con los iones de hidronio positivos (H 3 O + ) para formar agua. Los iones de hidronio positivos que se acercan al cátodo se combinan principalmente con iones de hidróxido negativos para formar agua. Relativamente pocos hidronios / iones hidróxido llegan al cátodo / ánodo. Esto puede causar un exceso de potencial de concentración en ambos electrodos.
El agua pura es un aislante bastante bueno ya que tiene una autoionización baja , K w = 1.0 × 10 −14 a temperatura ambiente y, por lo tanto, el agua pura conduce mal la corriente, 0.055 µS · cm −1 . [9] A menos que se aplique un potencial muy grande para provocar un aumento en la autoionización del agua, la electrólisis del agua pura avanza muy lentamente, limitada por la conductividad general.
Si se agrega un electrolito soluble en agua, la conductividad del agua aumenta considerablemente. El electrolito se disocia en cationes y aniones; los aniones se precipitan hacia el ánodo y neutralizan la acumulación de H + cargado positivamente allí; de manera similar, los cationes se precipitan hacia el cátodo y neutralizan la acumulación de OH - cargado negativamente allí. Esto permite el flujo continuo de electricidad. [10]
Electrolito para la electrólisis del agua [ editar ]
Se debe tener cuidado al elegir un electrolito, ya que un anión del electrolito compite con los iones hidróxido para ceder un electrón . Un anión de electrolito con un potencial de electrodo menos estándar que el hidróxido se oxidará en lugar del hidróxido y no se producirá oxígeno gaseoso. En su lugar, se reducirá un catión con un potencial de electrodo estándar mayor que un ion de hidrógeno y no se producirá gas hidrógeno.
Los siguientes cationes tienen un potencial de electrodo más bajo que H + y, por lo tanto, son adecuados para su uso como cationes de electrolitos: Li + , Rb + , K + , Cs + , Ba 2+ , Sr 2+ , Ca 2+ , Na + y Mg 2 + . El sodio y el litio se utilizan con frecuencia, ya que forman sales solubles y económicas.
Si se usa un ácido como electrolito, el catión es H + y no hay competidor para el H + creado al disociar el agua. El anión más utilizado es el sulfato ( SO2−
4), ya que es muy difícil de oxidar, siendo el potencial estándar de oxidación de este ión al ión peroxidisulfato de +2.010 voltios. [11]
Los ácidos fuertes como el ácido sulfúrico (H 2 SO 4 ) y las bases fuertes como el hidróxido de potasio (KOH) y el hidróxido de sodio (NaOH) se utilizan con frecuencia como electrolitos debido a sus fuertes capacidades conductoras.
También se puede usar un electrolito de polímero sólido como Nafion y cuando se aplica con un catalizador especial en cada lado de la membrana puede dividir eficientemente la molécula de agua con tan solo 1,5 voltios. Se han probado y desarrollado varios otros sistemas de electrolitos sólidos con varios sistemas de electrólisis ahora disponibles comercialmente que utilizan electrolitos sólidos. [12]
Electrólisis de agua pura [ editar ]
La electrólisis de agua pura libre de electrolitos se ha logrado mediante el uso de celdas electroquímicas nanogap de longitud inferior a Debye . Cuando la distancia entre el cátodo y el ánodo es incluso menor que la longitud de Debye (1 micrón en agua pura, alrededor de 220 nm en agua destilada), las regiones de doble capa de dos electrodos pueden superponerse entre sí, lo que lleva a un campo eléctrico uniformemente alto distribuido en el interior. toda la brecha. Un campo eléctrico tan alto puede mejorar significativamente el transporte de iones dentro del agua (principalmente debido a la migración), mejorando aún más la autoionización del agua y manteniendo toda la reacción continua, y mostrando una pequeña resistencia entre los dos electrodos. En este caso, las dos medias reaccionesestán acoplados y limitados por pasos de transferencia de electrones (la corriente de electrólisis se satura cuando se reduce aún más la distancia del electrodo). [13]
Técnicas [ editar ]
Demostración fundamental [ editar ]
Dos cables , que van desde los terminales de una batería, se colocan en una taza de agua con una cantidad de electrolito para establecer la conductividad en la solución. El uso de NaCl (sal de mesa) en una solución de electrolito produce cloro gaseoso en lugar de oxígeno debido a una semirreacción competitiva . Con los electrodos correctos y el electrolito correcto, como bicarbonato de sodio ( bicarbonato de sodio ), los gases de hidrógeno y oxígeno fluirán desde los electrodos con carga opuesta . El oxígeno se acumulará en el electrodo cargado positivamente ( ánodo ) y el hidrógeno se acumulará en el electrodo cargado negativamente ( cátodo ). Nota que el hidrógeno está cargado positivamente en el H 2O molécula, por lo que termina en el electrodo negativo. (Y viceversa para el oxígeno).
Tenga en cuenta que una solución acuosa de agua con iones de cloruro, cuando se electroliza, dará como resultado OH - si la concentración de Cl - es baja, o en cloro gaseoso que se descargará preferentemente si la concentración de Cl - es superior al 25% en masa en la solución.
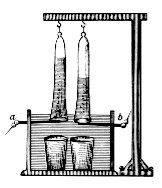
Voltímetro de Hofmann [ editar ]
El voltímetro de Hofmann se utiliza a menudo como una celda electrolítica a pequeña escala. Consta de tres cilindros verticales unidos. El cilindro interior está abierto en la parte superior para permitir la adición de agua y electrolito. Se coloca un electrodo de platino en la parte inferior de cada uno de los dos cilindros laterales, conectado a los terminales positivo y negativo de una fuente de electricidad . Cuando la corriente pasa por el voltímetro de Hofmann, se forma oxígeno gaseoso en el ánodo (positivo) e hidrógeno gaseoso en el cátodo (negativo). Cada gas desplaza el agua y se acumula en la parte superior de los dos tubos exteriores, de donde se puede extraer con una llave de paso.
Industrial [ editar ]
Muchas celdas de electrólisis industrial son muy similares a los voltámetros de Hofmann , con placas de platino complejas o panales como electrodos. Generalmente, la única vez que se produce hidrógeno intencionalmente a partir de la electrólisis es para la aplicación específica del punto de uso, como es el caso de las antorchas de oxígeno o cuando se desea hidrógeno u oxígeno de pureza extremadamente alta . La gran mayoría del hidrógeno se produce a partir de hidrocarburos y, como resultado, contiene trazas de monóxido de carbono entre otras impurezas. La impureza de monóxido de carbono puede ser perjudicial para varios sistemas, incluidas muchas pilas de combustible .
Alta presión [ editar ]
La electrólisis de alta presión es la electrólisis del agua con una salida de hidrógeno comprimido de alrededor de 12-20 MPa (120-200 Bar , 1740-2 900 psi ). [14] Presurizando el hidrógeno en el electrolizador, se elimina la necesidad de un compresor de hidrógeno externo ; el consumo medio de energía para la compresión interna es de alrededor del 3%. [15]
Alta temperatura [ editar ]
La electrólisis de alta temperatura (también HTE o electrólisis de vapor) es un método que se está investigando actualmente para la electrólisis del agua con un motor térmico . La electrólisis a alta temperatura puede ser preferible a la electrólisis tradicional a temperatura ambiente porque parte de la energía se suministra como calor, que es más barata que la electricidad, y porque la reacción de electrólisis es más eficiente a temperaturas más altas. [16] [17]
Agua alcalina [ editar ]
Membrana de electrolito de polímero [ editar ]
Níquel / hierro [ editar ]
En 2014, los investigadores anunciaron un sistema de electrólisis hecho de níquel y hierro abundantes y económicos en lugar de catalizadores de metales preciosos, como platino o iridio. La estructura de níquel-metal / óxido de níquel es más activa que el níquel metal puro o el óxido de níquel puro solo. El catalizador reduce significativamente el voltaje requerido . [18] [19] También se están investigando las baterías de níquel-hierro para su uso como baterías combinadas y electrólisis para la producción de hidrógeno. Esos "battolizadores" podrían cargarse y descargarse como baterías convencionales y producirían hidrógeno cuando estuvieran completamente cargados. [20]
Células electroquímicas Nanogap [ editar ]
En 2017, los investigadores informaron sobre el uso de celdas electroquímicas nanogap para lograr una electrólisis de agua pura sin electrolitos de alta eficiencia a temperatura ambiente. En las celdas electroquímicas de nanogap, los dos electrodos están tan cerca entre sí (incluso más pequeños que la longitud de Debye en agua pura) que la tasa de transporte de masa puede ser incluso mayor que la tasa de transferencia de electrones, lo que lleva a dos semirreacciones acopladas y limitado por el paso de transferencia de electrones. Los experimentos muestran que la densidad de corriente eléctrica de la electrólisis de agua pura puede ser incluso mayor que la de una solución de hidróxido de sodio de 1 mol / L. El mecanismo, "Mecanismo de ruptura virtual", es completamente diferente de la teoría electroquímica tradicional bien establecida, debido a tal efecto de tamaño de nanogap.[13]
Aplicaciones [ editar ]
Aproximadamente el cinco por ciento del gas hidrógeno producido en todo el mundo se crea por electrólisis. Actualmente, la mayoría de los métodos industriales producen hidrógeno a partir de gas natural en el proceso de reformado con vapor . La mayor parte del hidrógeno producido a través de la electrólisis es un subproducto en la producción de cloro y sosa cáustica . Este es un excelente ejemplo de una reacción secundaria competitiva .
- 2NaCl + 2H 2 O → Cl 2 + H 2 + 2NaOH
En el proceso cloro-álcali (electrólisis de salmuera), una mezcla de agua / cloruro de sodio es solo la mitad de la electrólisis del agua, ya que los iones de cloruro se oxidan a cloro en lugar de que el agua se oxide. Termodinámicamente, esto no sería de esperar ya que el potencial de oxidación del ión cloruro es menor que el del agua, pero la velocidad de la reacción del cloruro es mucho mayor que la del agua, lo que hace que predomine. El hidrógeno producido a partir de este proceso se quema (convirtiéndolo de nuevo en agua), se utiliza para la producción de productos químicos especiales o varias otras aplicaciones a pequeña escala.
La electrólisis del agua también se utiliza para generar oxígeno para la Estación Espacial Internacional . [21] [22]
Posteriormente, el hidrógeno se puede utilizar en una pila de combustible como método de almacenamiento de energía y agua. [23]
Eficiencia [ editar ]
Producción industrial [ editar ]
Eficiencia de generadores de hidrógeno modernas se mide por la energía consumida por unidad de volumen estándar de hidrógeno (MJ / m 3 ), suponiendo temperatura y presión estándar de la H 2 . Cuanto menor sea la energía utilizada por un generador, mayor será su eficiencia; un electrolizador 100% eficiente consumiría 39,4 kilovatios-hora por kilogramo (142 MJ / kg) de hidrógeno , [24] 12,749 julios por litro (12,75 MJ / m 3 ). La electrólisis práctica (utilizando un electrolizador giratorio a una presión de 15 bar) puede consumir 50 kW⋅h / kg (180 MJ / kg) y otros 15 kW⋅h (54 MJ) si el hidrógeno se comprime para su uso en coches de hidrógeno. [25]
Los proveedores de electrolizadores proporcionan eficiencias basadas en la entalpía . Para evaluar la eficiencia declarada de un electrolizador, es importante establecer cómo lo definió el proveedor (es decir, qué valor de entalpía, qué densidad de corriente, etc.).
Hay dos tecnologías principales disponibles en el mercado, electrolizadores alcalinos y de membrana de intercambio de protones (PEM). Los electrolizadores alcalinos son más baratos en términos de inversión (generalmente usan catalizadores de níquel), pero menos eficientes; Los electrolizadores PEM, por el contrario, son más costosos (generalmente usan catalizadores de metales del grupo del platino costosos) pero son más eficientes y pueden operar a densidades de corriente más altas y, por lo tanto, pueden ser posiblemente más baratos si la producción de hidrógeno es lo suficientemente grande.
La electrólisis alcalina convencional tiene una eficiencia de aproximadamente el 70%. [26] Teniendo en cuenta el uso aceptado del valor calorífico superior (porque la ineficiencia a través del calor puede redirigirse al sistema para crear el vapor requerido por el catalizador), las eficiencias de trabajo promedio para la electrólisis PEM son de alrededor del 80%. [27] [28] Se espera que esto aumente entre el 82 y el 86% [29] antes de 2030. Se prevé que la eficiencia teórica de los electrolizadores PEM sea de hasta un 94%. [30]
Teniendo en cuenta la producción industrial de hidrógeno y utilizando los mejores procesos actuales para la electrólisis del agua (PEM o electrólisis alcalina) que tienen una eficiencia eléctrica efectiva del 70 al 80%, [31] [32] [33] produciendo 1 kg de hidrógeno (que ha una energía específica de 143 MJ / kg) requiere de 50 a 55 kW⋅h (180 a 200 MJ) de electricidad. A un costo de electricidad de $ 0.06 / kW · h, según lo establecido en los objetivos de producción de hidrógeno del Departamento de Energía de EE. UU. Para 2015, [34] el costo del hidrógeno es de $ 3 / kg. Con el rango de precios del gas natural de 2016 como se muestra en el gráfico ( Hoja de ruta del equipo tecnológico de producción de hidrógeno, noviembre de 2017) poniendo el costo del hidrógeno reformado con vapor de metano (SMR) entre $ 1.20 y $ 1.50, el precio de costo del hidrógeno a través de la electrólisis sigue siendo superior al doble de los precios objetivo del hidrógeno del DOE para 2015. El precio objetivo del DOE de EE. UU. Para el hidrógeno en 2020 es de $ 2,30 / kg, lo que requiere un costo de electricidad de $ 0,037 / kW · h, que se puede lograr con las licitaciones de PPA de 2018 [35] para energía eólica y solar en muchas regiones. Esto pone el equivalente galón $ 4 / gasolina (ESB) H 2 bien objetivo dispensado a su alcance, y cerca de un coste de producción de gas natural ligeramente elevada para SMR.
En otras partes del mundo, el precio del hidrógeno SMR oscila entre 1 y 3 dólares / kg en promedio. Esto hace que la producción de hidrógeno a través de la electrólisis sea competitiva en muchas regiones ya, como describen Nel Hydrogen [36] y otros, incluido un artículo de la IEA [37] que examina las condiciones que podrían conducir a una ventaja competitiva para la electrólisis.
Sobrepotencial [ editar ]
Los electrolizadores de agua real requieren voltajes más altos para que prosiga la reacción. La parte que supera 1,23 V [38] se denomina sobrepotencial o sobretensión, y representa cualquier tipo de pérdida y no idealidad en el proceso electroquímico.
Para una celda bien diseñada, el mayor sobrepotencial es el sobrepotencial de reacción para la oxidación de cuatro electrones del agua a oxígeno en el ánodo; Los electrocatalizadores pueden facilitar esta reacción y las aleaciones de platino son el estado de la técnica para esta oxidación. El desarrollo de un electrocatalizador económico y eficaz para esta reacción sería un gran avance y es un tema de investigación actual; Hay muchos enfoques, entre ellos una receta de hace 30 años para el sulfuro de molibdeno , [39] puntos cuánticos de grafeno , [40] nanotubos de carbono , [19] perovskita , [41] y níquel / óxido de níquel. [42][43] Recientemente se ha descubierto que el fosfuro de trimolibdeno (Mo3P) es un candidato prometedor para metales no preciosos y abundantes en tierra con excelentes propiedades catalíticas que se pueden utilizar para procesos electrocatalíticos. El rendimiento catalítico de las nanopartículas de Mo3P se prueba en la reacción de desprendimiento de hidrógeno (HER), lo que indica un potencial de inicio de tan solo 21 mV, una tasa de formación de H2 y una densidad de corriente de intercambio de 214,7 µmol s − 1 g − 1 cat (a solo 100 sobrepotencial mV) y 279,07 µA cm-2, respectivamente, que se encuentran entre los valores más cercanos observados hasta ahora al platino. [44] [45] La reacción de dos electrones más simple para producir hidrógeno en el cátodo puede ser electrocatalizada casi sin sobrepotencial por platino, o en teoría una enzima hidrogenasa. Si se utilizan otros materiales menos eficaces para el cátodo (por ejemplo, grafito ), aparecerán grandes sobrepotenciales.
Termodinámica [ editar ]
La electrólisis del agua en condiciones estándar requiere un mínimo teórico de 237 kJ de entrada de energía eléctrica para disociar cada mol de agua, que es la energía libre de formación de agua de Gibbs estándar . También requiere energía para superar el cambio de entropía de la reacción. Por lo tanto, el proceso no puede continuar por debajo de 286 kJ por mol si no se agrega calor / energía externa.
Dado que cada mol de agua requiere dos moles de electrones , y dado que la constante de Faraday F representa la carga de un mol de electrones (96485 C / mol), se deduce que el voltaje mínimo necesario para la electrólisis es de aproximadamente 1,23 V. [46] Si la electrólisis se realiza a alta temperatura, este voltaje se reduce. Esto permite que el electrolizador funcione con eficacia eléctrica superior al 100%. En los sistemas electroquímicos, esto significa que se debe suministrar calor al reactor para mantener la reacción. De esta manera, la energía térmica se puede utilizar para parte del requerimiento de energía de electrólisis. [47]De manera similar, el voltaje requerido se puede reducir (por debajo de 1 V) si los combustibles (como carbón, alcohol, biomasa) reaccionan con agua (electrolizador basado en PEM a baja temperatura) u iones de oxígeno (electrolizador basado en electrolito de óxido sólido a alta temperatura). ). Esto da como resultado que parte de la energía del combustible se utilice para "ayudar" al proceso de electrólisis y puede reducir el costo total del hidrógeno producido. [48]
Sin embargo, al observar el componente de entropía (y otras pérdidas), se requieren voltajes superiores a 1,48 V para que la reacción proceda a densidades de corriente prácticas (el voltaje termoneutral ).
En el caso de la electrólisis del agua, la energía libre de Gibbs representa el trabajo mínimo necesario para que prosiga la reacción, y la entalpía de reacción es la cantidad de energía (tanto trabajo como calor) que debe proporcionarse para que los productos de reacción estén a la misma temperatura. como reactivo (es decir, temperatura estándar para los valores dados anteriormente). Potencialmente, un electrolizador que funcione a 1,48 V sería 100% eficiente. [ cita requerida ]
Ver también [ editar ]
- Electrocatalizador
- Electroquímica
- Célula electroquímica
- Ingeniería electroquímica
- Electrólisis
- Galleta de gas
- Producción de hidrógeno
- Pirolisis de metano (para hidrógeno)
- Noryl
- División de agua fotocatalítica
- Cronología de las tecnologías de hidrógeno
- Purificación del agua
Referencias [ editar ]
- ^ Levie, R. de (octubre de 1999). "La electrólisis del agua". Revista de Química Electroanalítica . 476 (1): 92–93. doi : 10.1016 / S0022-0728 (99) 00365-4 .[ enlace muerto ]
- ^ Davy, John, ed. (1839). "Sobre algunas agencias químicas de electricidad" . Las obras completas de Sir Humphry Davy . 5 . págs. 1-12.
- ^ Lachinov Dmitry Aleksandrovich Archivado el 26 de julio de 2011 en Wayback Machine en Great Cyrill and Methodius Encyclopedia (en ruso)
- ^ Zumdahl, Steven S .; Zumdahl, Susan A. (1 de enero de 2013). Química (9ª ed.). Cengage Learning . pag. 866. ISBN 978-1-13-361109-7.
- ^ Carmo, M; Fritz D; Mergel J; Stolten D (2013). "Una revisión completa sobre la electrólisis del agua PEM". Revista de energía de hidrógeno . 38 (12): 4901–4934. doi : 10.1016 / j.ijhydene.2013.01.151 .
- ^ "Conceptos básicos de hidrógeno - producción" . Centro de Energía Solar de Florida. 2007. Archivado desde el original el 18 de febrero de 2008 . Consultado el 5 de febrero de 2008 .
- ^ potencial de electrodo estándar (página de datos)
- ^ Colli, AN; et al. (2019). "Electrodos no preciosos para la electrólisis de agua alcalina práctica" . Materiales . 12 (8): 1336. doi : 10.3390 / ma12081336 . PMC 6515460 . PMID 31022944 .
- ^ Luz, Truman S .; Licht, Stuart; Bevilacqua, Anthony C .; Morash, Kenneth R. (1 de enero de 2005). "La conductividad y resistividad fundamentales del agua". Letras electroquímicas y de estado sólido . 8 (1): E16 – E19. doi : 10.1149 / 1.1836121 . ISSN 1099-0062 . S2CID 54511887 .
- ^ Pauling, Linus (1970) Química general , sección 15-2. San Francisco.
- ^ Manual CRC de química y física: un libro de referencia de datos químicos y físicos . Haynes, William M. (93ª ed., 2012-2013 ed.). Boca Raton, Fla .: CRC. 2012. ISBN 9781439880494. OCLC 793213751 .CS1 maint: otros ( enlace )
- ^ Badwal, SPS; Giddey S; Munnings C (2012). "Producción de hidrógeno por vías electrolíticas sólidas" . ALAMBRES Energía y Medio Ambiente . 2 (5): 473–487. doi : 10.1002 / wene.50 . Archivado desde el original el 2 de junio de 2013 . Consultado el 23 de enero de 2013 .
- ^ a b Wang, Yifei; Narayanan, SR; Wu, Wei (11 de julio de 2017). "División asistida por campo de agua pura basada en celdas electroquímicas Nanogap de longitud profunda por debajo de Debye". ACS Nano . 11 (8): 8421–8428. doi : 10.1021 / acsnano.7b04038 . ISSN 1936-0851 . PMID 28686412 .
- ^ 2001-Electrólisis de alta presión: la tecnología clave para un H.2 eficiente [ enlace muerto ]
- ^ Ghosh, PC; Emonts, B; Janßen, H; Mergel, J; Stolten, D (2003). "Diez años de experiencia operativa con un sistema de suministro de energía renovable basado en hidrógeno" (PDF) . Energía solar . 75 (6): 469–478. Código Bibliográfico : 2003SoEn ... 75..469G . doi : 10.1016 / j.solener.2003.09.006 . Archivado desde el original el 27 de marzo de 2009. CS1 maint: URL no apta ( enlace )
- ^ "Electrólisis de alta temperatura mediante SOEC" . Hola2h2. Archivado desde el original el 3 de marzo de 2016 . Consultado el 5 de mayo de 2016 .
- ^ "WELTEMPWater electrólisis a temperaturas elevadas" . Weltemp.eu. 31 de diciembre de 2010. Archivado desde el original el 3 de marzo de 2016 . Consultado el 5 de mayo de 2016 .
- ^ "Un divisor de agua de bajo costo que funciona con una batería AAA normal" . KurzweilAI . 22 de agosto de 2014. Archivado desde el original el 16 de abril de 2015 . Consultado el 11 de abril de 2015 .
- ^ a b Gong, Ming; Zhou, Wu; Tsai, Mon-Che; Zhou, Jigang; Guan, Mingyun; Lin, Meng-Chang; Zhang, Bo; Hu, Yongfeng; Wang, Di-Yan; Yang, Jiang; Pennycook, Stephen J .; Hwang, Bing-Joe; Dai, Hongjie (2014). "Heteroestructuras de óxido de níquel / níquel a nanoescala para electrocatálisis de desprendimiento de hidrógeno activo" . Comunicaciones de la naturaleza . 5 : 4695. Bibcode : 2014NatCo ... 5.4695G . doi : 10.1038 / ncomms5695 . PMID 25146255 .
- ^ Mulder, FM; et al. (2017). "Almacenamiento de electricidad eficiente con el battolyser, una batería de Ni-Fe integrada y un electrolizador" . Ciencias Energéticas y Ambientales . 10 (3): 756–764. doi : 10.1039 / C6EE02923J .
- ^ "Hacer el espacio más seguro con electrólisis" . ASME . Archivado desde el original el 15 de mayo de 2012 . Consultado el 26 de mayo de 2012 .
- ^ "Respirando tranquilo en la estación espacial" . Ciencia de la NASA. Archivado desde el original el 19 de mayo de 2012 . Consultado el 26 de mayo de 2012 .
- ^ "Calentador de agua de pila de combustible de hidrógeno solar (soporte educativo)" . Archivado desde el original el 8 de agosto de 2016 . Consultado el 9 de septiembre de 2017 , a través de Scribd .
- ^ Luca Bertuccioli; et al. (7 de febrero de 2014). "Desarrollo de la electrólisis del agua en la Unión Europea" (PDF) . Empresa Común Clientes de Pilas de Combustible e Hidrógeno .
- ^ Stensvold, Tore (26 de enero de 2016). «Coca-Cola-oppskrift» kan gjøre hidrógeno hasta nytt norsk industrieventyr Archivado el 5 de marzo de 2016 en Wayback Machine . Teknisk Ukeblad ,.
- ^ Stolten, Detlef (4 de enero de 2016). Ciencia e Ingeniería del Hidrógeno: Materiales, Procesos, Sistemas y Tecnología . John Wiley e hijos. pag. 898. ISBN 9783527674299. Archivado desde el original el 22 de abril de 2018 . Consultado el 22 de abril de 2018 .
- ↑ Bernholz, Jan (13 de septiembre de 2018). "Aplicaciones de almacenamiento de energía anteriores, actuales y posibles futuras de RWE" (PDF) . RWE . pag. 10.
Eficiencia total: 70% o 86% (uso de calor residual)
- ^ "ITM - infraestructura de reabastecimiento de hidrógeno - febrero de 2017" (PDF) . level-network.com . Archivado (PDF) desde el original el 17 de abril de 2018 . Consultado el 17 de abril de 2018 .
- ^ "Reducción de costos y aumento de rendimiento de electrolizadores PEM" (PDF) . Europa (portal web). Archivado (PDF) desde el original el 17 de abril de 2018 . Consultado el 17 de abril de 2018 .
- ^ Bjørnar Kruse; Sondre Grinna; Cato Buch (13 de febrero de 2002). "Hidrógeno: estado y posibilidades" (PDF) . La Fundación Bellona. pag. 20. Archivado desde el original el 16 de septiembre de 2013. CS1 maint: URL no apta ( enlace )
- ^ Werner Zittel; Reinhold Wurster (8 de julio de 1996). "Capítulo 3: Producción de hidrógeno. Parte 4: Producción a partir de electricidad mediante electrólisis" . HyWeb: Conocimiento - Hidrógeno en el Sector Energético . Ludwig-Bölkow-Systemtechnik GmbH. Archivado desde el original el 7 de febrero de 2007 . Consultado el 14 de enero de 2006 .
- ^ Bjørnar Kruse; Sondre Grinna; Cato Buch (13 de febrero de 2002). "Hidrógeno: estado y posibilidades" . La Fundación Bellona. Archivado desde el original (PDF) el 2 de julio de 2011.
Se predicen factores de eficiencia para electrolizadores PEM de hasta el 94%, pero esto es solo teórico en este momento.
- ^ "electrólisis de agua 3D de alta velocidad y alta eficiencia" . Grid-shift.com. Archivado desde el original el 22 de marzo de 2012 . Consultado el 13 de diciembre de 2011 .
- ^ "Objetivos técnicos DOE para la producción de hidrógeno a partir de electrólisis" . energy.gov . Departamento de Energía de EE. UU. Archivado desde el original el 23 de abril de 2018 . Consultado el 22 de abril de 2018 .
- ^ Deign, Jason. "Xcel atrae precios bajos 'sin precedentes' para energía solar y eólica combinados con almacenamiento" . greentechmedia.com . Wood MacKenzie. Archivado desde el original el 4 de febrero de 2018 . Consultado el 22 de abril de 2018 .
- ^ "Amplia adaptación de la solución competitiva de hidrógeno" (PDF) . nelhydrogen.com . Nel ASA. Archivado (PDF) desde el original el 22 de abril de 2018 . Consultado el 22 de abril de 2018 .
- ^ Philibert, Cédric. "Comentario: producción de hidrógeno industrial a partir de energías renovables" . iea.org . Agencia Internacional de Energía. Archivado desde el original el 22 de abril de 2018 . Consultado el 22 de abril de 2018 .
- ^ 1,23 V es el potencial estándar; en condiciones no estándar puede ser diferente, en particular, disminuye con la temperatura.
- ^ Kibsgaard, Jakob; Jaramillo, Thomas F .; Besenbacher, Flemming (2014). "Construcción de un motivo de sitio activo apropiado en un catalizador de evolución de hidrógeno con grupos de tiomolibdato [Mo 3 S 13 ] 2 - " . Química de la naturaleza . 6 (3): 248-253. Código bibliográfico : 2014NatCh ... 6..248K . doi : 10.1038 / nchem.1853 . PMID 24557141 .
- ^ Fei, Huilong; Vosotros, Ruquan; Vosotros, Gonglan; Gong, Yongji; Peng, Zhiwei; Fan, Xiujun; Samuel, Errol LG; Ajayan, Pulickel M .; Gira, James M. (2014). "Puntos cuánticos de grafeno dopado con boro y nitrógeno / nanoplaquetas híbridas de grafeno como electrocatalizadores eficientes para la reducción de oxígeno". ACS Nano . 8 (10): 10837–43. doi : 10.1021 / nn504637y . PMID 25251218 .
- ^ Luo, J .; Im, J.-H .; Mayer, MT; Schreier, M .; Nazeeruddin, MK; Park, N.-G .; Tilley, SD; Fan, HJ; Gratzel, M. (2014). "Fotólisis del agua al 12,3% de eficiencia a través de energía fotovoltaica de perovskita y catalizadores abundantes en la Tierra". Ciencia . 345 (6204): 1593-1596. Código bibliográfico : 2014Sci ... 345.1593L . doi : 10.1126 / science.1258307 . PMID 25258076 .
- ^ Shwartz, Mark (22 de agosto de 2014). "Los científicos de Stanford desarrollan un divisor de agua que funciona con una batería AAA normal" . News.stanford.edu. Archivado desde el original el 16 de abril de 2016 . Consultado el 5 de mayo de 2016 .
- ^ "Los científicos desarrollan un divisor de agua que funciona con una batería AAA ordinaria" . Technology.org. 25 de agosto de 2014 . Consultado el 5 de mayo de 2016 .
- ^ Kondori, Alireza (2 de mayo de 2019). "Identificación de sitios activos catalíticos de fosfuro de trimolibdeno (Mo3P) para la evolución electroquímica del hidrógeno" . Materiales energéticos avanzados . AdvancedEnergyMaterials. 9 (22): 1900516. doi : 10.1002 / aenm.201900516 .
- ^ Shi, Yanmei (25 de enero de 2016). "Avances recientes en nanomateriales de fosfuro de metales de transición: síntesis y aplicaciones en la reacción de evolución de hidrógeno". Reseñas de la Sociedad Química . ChemicalSocietyReviews. 45 (6): 1529-1541. doi : 10.1039 / C5CS00434A . PMID 26806563 .
- ^ Hyman D. Gesser (2002). Química aplicada . Saltador. págs. 16–. ISBN 978-0-306-46700-4. Consultado el 18 de diciembre de 2011 .
- ^ Badwal, Sukhvinder PS; Giddey, Sarbjit; Munnings, Christopher (septiembre de 2013). "Producción de hidrógeno por vías electrolíticas sólidas". Revisiones interdisciplinarias de Wiley: Energía y medio ambiente . 2 (5): 473–487. doi : 10.1002 / wene.50 . S2CID 135539661 .
- ^ Badwal, Sukhvinder PS; Giddey, Sarbjit S .; Munnings, Christopher; Bhatt, Anand I .; Hollenkamp, Anthony F. (24 de septiembre de 2014). "Tecnologías emergentes de conversión y almacenamiento de energía electroquímica (acceso abierto)" . Fronteras de la química . 2 : 79. Código bibliográfico : 2014FrCh .... 2 ... 79B . doi : 10.3389 / fchem.2014.00079 . PMC 4174133 . PMID 25309898 .
Enlaces externos [ editar ]
| Wikimedia Commons tiene medios relacionados con la electrólisis del agua . |
- "Electrólisis del agua" . Experimentos de electroquímica . Consultado el 20 de noviembre de 2005 .
- "Electrólisis del agua" . Haz Chem 044 . Archivado desde el original el 14 de marzo de 2006 . Consultado el 20 de noviembre de 2005 .
- EERE 2008 - Estudio comercial de 100 kgH2 / día
- NREL 2006 - Informe técnico de electrólisis