Galvanoplastia
La galvanoplastia es un nombre general para los procesos que producen un recubrimiento metálico sobre un sustrato sólido mediante la reducción de cationes de ese metal por medio de una corriente eléctrica continua . La parte a recubrir actúa como cátodo ( electrodo negativo ) de una celda electrolítica ; el electrolito es una solución de una sal del metal a recubrir; y el ánodo (electrodo positivo) suele ser un bloque de ese metal o de algún material conductor inerte . La corriente es proporcionada por una fuente de alimentación externa..
La galvanoplastia se usa ampliamente en la industria y las artes decorativas para mejorar las cualidades superficiales de los objetos, como la resistencia a la abrasión y la corrosión , la lubricidad , la reflectividad , la conductividad eléctrica o la apariencia. También se puede utilizar para aumentar el grosor en piezas de tamaño insuficiente o desgastadas, o para fabricar placas de metal con formas complejas, un proceso llamado electroformado . También se utiliza para depurar metales como el cobre .
El término "galvanoplastia" también se puede usar ocasionalmente para procesos que usan una corriente eléctrica para lograr la oxidación de aniones sobre un sustrato sólido, como en la formación de cloruro de plata sobre alambre de plata para fabricar electrodos de plata / cloruro de plata .
El electropulido , un proceso que utiliza una corriente eléctrica para eliminar los cationes metálicos de la superficie de un objeto metálico, puede considerarse lo opuesto a la galvanoplastia. [1]
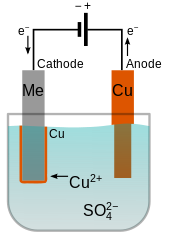
El electrolito debe contener iones positivos (cationes) del metal a depositar. Estos cationes se reducen en el cátodo al metal en el estado de valencia cero. Por ejemplo, el electrolito para el recubrimiento de cobre puede ser una solución de sulfato de cobre (II) , que se disocia en cationes Cu 2+ y SO2−
4aniones. En el cátodo, el Cu 2+ se reduce a cobre metálico al ganar dos electrones.
Cuando el ánodo está hecho del metal de recubrimiento, puede ocurrir la reacción opuesta, convirtiéndolo en cationes disueltos. Por ejemplo, el cobre se oxidaría en el ánodo a Cu 2+ al perder dos electrones. En este caso, la velocidad a la que se disuelve el ánodo será igual a la velocidad a la que se recubre el cátodo y, por lo tanto, el ánodo repone continuamente los iones en el baño de electrolito. El resultado neto es la transferencia efectiva de metal desde la fuente del ánodo al cátodo. [2]