Fuego
Una llama (del latín flamma ) es la parte gaseosa visible de un fuego . Es causado por una reacción química altamente exotérmica que tiene lugar en una zona delgada. [1] Las llamas muy calientes son lo suficientemente calientes como para tener componentes gaseosos ionizados de suficiente densidad para ser considerados plasma . [ vago ] [ cita requerida ]
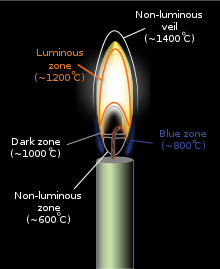
El color y la temperatura de una llama dependen del tipo de combustible involucrado en la combustión, como, por ejemplo, cuando se acerca un encendedor a una vela . El calor aplicado hace que las moléculas de combustible en la cera de la vela se vaporicen (si este proceso ocurre en una atmósfera inerte sin oxidante , se llama pirólisis ). En este estado, pueden reaccionar fácilmente con el oxígeno del aire, que emite suficiente calor en la reacción exotérmica posterior para vaporizar aún más combustible, manteniendo así una llama constante. La alta temperatura de la llama hace que las moléculas de combustible vaporizadas se descompongan , formando varios productos de combustión incompleta y radicales libres., y estos productos luego reaccionan entre sí y con el comburente involucrado en la reacción de la siguiente llama (fuego). Uno puede investigar todas las diferentes partes de la llama de una vela con una cuchara de metal frío: [2] Las partes superiores son vapor de agua, resultado de la combustión; las partes amarillas en el medio son hollín; justo al lado de la mecha de la vela hay cera sin quemar. Los orfebres usan las partes más altas de una llama con un soplete metálico para fundir el oro y la plata. La energía suficiente en la llama excitará los electrones en algunos de los intermedios de reacción transitorios, como el radical metilidino (CH) y el carbono diatómico (C 2), lo que da como resultado la emisión de luz visible a medida que estas sustancias liberan su exceso de energía (consulte el espectro a continuación para obtener una explicación de qué especies de radicales específicos producen qué colores específicos). A medida que aumenta la temperatura de combustión de una llama (si la llama contiene pequeñas partículas de carbono sin quemar u otro material), también aumenta la energía promedio de la radiación electromagnética emitida por la llama (ver Cuerpo negro ).
Se pueden usar otros oxidantes además del oxígeno para producir una llama. La combustión de hidrógeno en cloro produce una llama y en el proceso emite cloruro de hidrógeno (HCl) gaseoso como producto de la combustión. [3] Otra de las muchas combinaciones químicas posibles es la hidracina y el tetróxido de nitrógeno , que es hipergólico y se usa comúnmente en motores de cohetes. Los fluoropolímeros se pueden utilizar para suministrar flúor como oxidante de combustibles metálicos, por ejemplo, en la composición de magnesio/teflón/vitón .
Las cinéticas químicas que ocurren en la llama son muy complejas y generalmente involucran una gran cantidad de reacciones químicas y especies intermedias, la mayoría de ellas radicales . Por ejemplo, un conocido esquema de cinética química, GRI-Mech, [4] utiliza 53 especies y 325 reacciones elementales para describir la combustión de biogás .
Existen diferentes métodos para distribuir los componentes necesarios de la combustión a una llama. En una llama de difusión , el oxígeno y el combustible se difunden entre sí; la llama se produce donde se encuentran. En una llama premezclada , el oxígeno y el combustible se mezclan previamente, lo que da como resultado un tipo diferente de llama. Las llamas de las velas (una llama de difusión) funcionan a través de la evaporación del combustible que se eleva en un flujo laminar de gas caliente que luego se mezcla con el oxígeno circundante y se quema.
El color de la llama depende de varios factores, siendo los más importantes la radiación de cuerpo negro y la emisión de banda espectral , y tanto la emisión de línea espectral como la absorción de línea espectral desempeñan papeles menores. En el tipo de llama más común, las llamas de hidrocarburos , el factor más importante que determina el color es el suministro de oxígeno y el grado de mezcla previa de combustible y oxígeno, que determina la velocidad de combustión y, por lo tanto, la temperatura y las rutas de reacción, produciendo así diferentes tonos de color. .