Calor latente
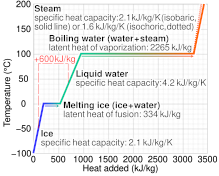
El calor latente (también conocido como energía latente o calor de transformación ) es la energía liberada o absorbida, por un cuerpo o un sistema termodinámico , durante un proceso de temperatura constante, generalmente una transición de fase de primer orden .
El calor latente puede entenderse como energía en forma oculta que se suministra o extrae para cambiar el estado de una sustancia sin cambiar su temperatura. Algunos ejemplos son el calor latente de fusión y el calor latente de vaporización que intervienen en los cambios de fase , es decir, una sustancia que se condensa o vaporiza a una temperatura y presión específicas. [1] [2]
El término fue introducido alrededor de 1762 por el químico británico Joseph Black . Se deriva del latín latere ( mentir escondido ). Black utilizó el término en el contexto de la calorimetría, donde una transferencia de calor provocó un cambio de volumen en un cuerpo mientras su temperatura era constante.
A diferencia del calor latente, el calor sensible es energía transferida en forma de calor , con un cambio de temperatura resultante en un cuerpo.
Los términos ″ calor sensible ″ y ″ calor latente ″ se refieren a la energía transferida entre un cuerpo y su entorno, definida por la ocurrencia o no ocurrencia de un cambio de temperatura; dependen de las propiedades del cuerpo. El ″ calor sensible ″ se ″ siente ″ o se siente en un proceso como un cambio en la temperatura corporal. El ″ calor latente ″ es energía transferida en un proceso sin cambio de temperatura corporal, por ejemplo, en un cambio de fase (sólido / líquido / gas).
Tanto los calores sensibles como los latentes se observan en muchos procesos de transferencia de energía en la naturaleza. El calor latente está asociado con el cambio de fase del agua atmosférica o del océano, vaporización , condensación , congelación o fusión , mientras que el calor sensible es energía transferida que es evidente en el cambio de temperatura de la atmósfera o el océano, o el hielo, sin esos cambios de fase. , aunque se asocia con cambios de presión y volumen.