Tabla periódica
La tabla periódica , también conocida como tabla periódica de ( los ) elementos químicos , es una visualización tabular de los elementos químicos . Se usa ampliamente en química , física y otras ciencias, y generalmente se considera un ícono de la química. Es una formulación gráfica de la ley periódica, que establece que las propiedades de los elementos químicos exhiben una dependencia periódica de sus números atómicos .
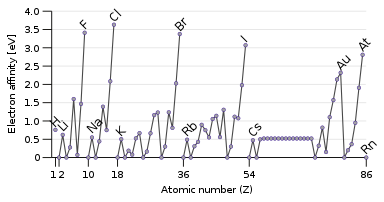
La mesa está dividida en cuatro áreas aproximadamente rectangulares llamadas bloques . Las filas de la tabla se denominan períodos y las columnas se denominan grupos . Los elementos del mismo grupo de columnas de la tabla periódica muestran características químicas similares. Las tendencias recorren la tabla periódica, con carácter no metálico (manteniendo sus propios electrones) aumentando de izquierda a derecha a lo largo de un período, y de abajo hacia arriba a través de un grupo, y carácter metálico (entregando electrones a otros átomos) aumentando en el opuesto. dirección. La razón subyacente de estas tendencias son las configuraciones electrónicas de los átomos.
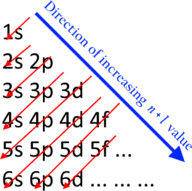
La primera tabla periódica generalmente aceptada fue la del químico ruso Dmitri Mendeleev en 1869: formuló la ley periódica como una dependencia de las propiedades químicas de la masa atómica. Debido a que entonces no se conocían todos los elementos, había espacios en su tabla periódica, y Mendeleev usó con éxito la ley periódica para predecir las propiedades de algunos de los elementos faltantes. La ley periódica fue reconocida como un descubrimiento fundamental a finales del siglo XIX, y se explicó con el descubrimiento del número atómico y el trabajo pionero en mecánica cuántica de principios del siglo XX que iluminó la estructura interna del átomo. Con el descubrimiento de Glenn T. Seaborg en 1945 de que los actínidoseran de hecho elementos de bloque f en lugar de bloque d, se alcanzó una forma reconociblemente moderna de la mesa. La tabla periódica y la ley son ahora una parte central e indispensable de la química moderna.
La tabla periódica continúa evolucionando con el progreso de la ciencia. En la naturaleza, solo existen elementos hasta el número atómico 94; para ir más allá, era necesario sintetizar nuevos elementos en el laboratorio. Hoy en día, se conocen todos los primeros 118 elementos, completando las primeras siete filas de la tabla, pero aún se necesita la caracterización química de los elementos más pesados para confirmar que sus propiedades coinciden con sus posiciones. Aún no se sabe cuánto se extenderá la tabla más allá de estas siete filas y si los patrones de la parte conocida de la tabla continuarán en esta región desconocida. También continúa cierta discusión científica sobre si algunos elementos están colocados correctamente en la tabla de hoy. Existen muchas representaciones alternativas de la ley periódica,y existe cierta discusión sobre si existe o no una forma óptima de la tabla periódica.
Los constituyentes más pequeños de toda la materia normal se conocen como átomos . Los átomos son extremadamente pequeños, miden alrededor de una diez mil millonésima parte de un metro de ancho; por tanto, su estructura interna está gobernada por la mecánica cuántica . [1] Los átomos consisten en un pequeño núcleo cargado positivamente , hecho de protones cargados positivamente y neutrones sin carga , rodeado por una nube de electrones cargados negativamente; las cargas se cancelan, por lo que los átomos son neutrales. [2] Los electrones participan en reacciones químicas , pero el núcleo no. [2]Cuando los átomos participan en reacciones químicas, pueden ganar o perder electrones para formar iones con carga positiva o negativa ; o pueden compartir electrones entre sí. [3]

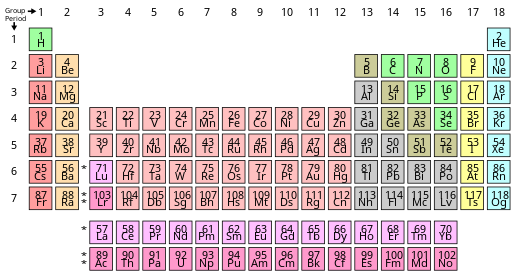
| Metales alcalinos Metales alcalinotérreos Lantánidos Actínidos Metales de transición | Otros metales Metaloides Otros no metales Halógenos Gases nobles |