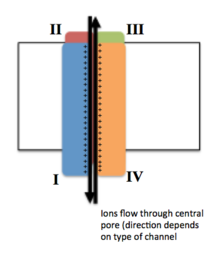
 Cada uno de los cuatro dominios homólogos constituye una subunidad del canal iónico. Los segmentos sensores de voltaje S4 (marcados con los símbolos +) se muestran cargados. | |
| Identificadores | |
|---|---|
| Símbolo | VIC |
| Clan pfam | CL0030 |
| TCDB | 1.A.1 |
| Superfamilia OPM | 8 |
| Proteína OPM | 2a79 |
Los canales iónicos activados por voltaje son una clase de proteínas transmembrana que forman canales iónicos que se activan por cambios en el potencial de la membrana eléctrica cerca del canal. El potencial de membrana altera la conformación de las proteínas del canal, regulando su apertura y cierre. Las membranas celulares son generalmente impermeables a los iones , por lo que deben difundirse a través de la membrana a través de canales proteicos transmembrana. Tienen un papel crucial en las células excitables como los tejidos neuronales y musculares, lo que permite una despolarización rápida y coordinada en respuesta al cambio de voltaje desencadenante . Encontrado a lo largo del axóny en la sinapsis , los canales iónicos activados por voltaje propagan direccionalmente señales eléctricas. Los canales iónicos activados por voltaje suelen ser específicos de iones y se han identificado canales específicos para los iones sodio (Na + ), potasio (K + ), calcio (Ca 2+ ) y cloruro (Cl - ). [1] La apertura y el cierre de los canales se desencadenan al cambiar la concentración de iones y, por lo tanto, el gradiente de carga entre los lados de la membrana celular. [2]
Estructura [ editar ]
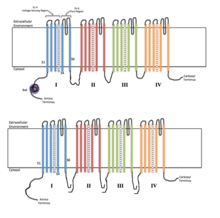
Los canales iónicos activados por voltaje generalmente se componen de varias subunidades dispuestas de tal manera que hay un poro central a través del cual los iones pueden viajar por sus gradientes electroquímicos . Los canales tienden a ser específicos de iones, aunque a veces iones cargados y de tamaño similar pueden viajar a través de ellos. La funcionalidad de los canales iónicos activados por voltaje se atribuye a sus tres unidades discretas principales: el sensor de voltaje, el poro o vía de conducción y la puerta. [3] Los canales de Na + , K + y Ca 2+ están compuestos por cuatro dominios transmembrana dispuestos alrededor de un poro central; estos cuatro dominios son parte de una sola subunidad α en el caso de la mayoría de Na + y Ca 2+canales, mientras que hay cuatro subunidades α, cada una de las cuales contribuye con un dominio transmembrana, en la mayoría de los canales de K + . [4] Los segmentos que atraviesan la membrana, designados S1-S6, todos toman la forma de hélices alfa con funciones especializadas. Los segmentos transmembrana quinto y sexto (S5 y S6) y el bucle de poros cumplen la función principal de conducción iónica, que comprenden la puerta y el poro del canal, mientras que S1-S4 sirven como región de detección de voltaje. [3] Las cuatro subunidades pueden ser idénticas o diferentes entre sí. Además de las cuatro subunidades α centrales, también hay subunidades β reguladoras, con oxidorreductasaactividad, que se encuentran en la superficie interna de la membrana celular y no cruzan la membrana, y que están ensambladas con las subunidades α en el retículo endoplásmico . [5]
Mecanismo [ editar ]
Los estudios cristalográficos estructurales de un canal de potasio han demostrado que, cuando se introduce una diferencia de potencial sobre la membrana, el campo eléctrico asociado induce un cambio conformacional en el canal de potasio. El cambio conformacional distorsiona la forma de las proteínas del canal lo suficiente como para que la cavidad, o canal, se abra para permitir que se produzca la entrada o salida a través de la membrana. Este movimiento de iones hacia abajo en sus gradientes de concentración genera posteriormente una corriente eléctrica suficiente para despolarizar la membrana celular.
Los canales de sodio y los canales de calcio dependientes de voltaje están formados por un único polipéptido con cuatro dominios homólogos. Cada dominio contiene 6 hélices alfa que atraviesan la membrana . Una de estas hélices, S4, es la hélice de detección de voltaje. [6] El segmento S4 contiene muchas cargas positivas, de modo que una carga positiva alta fuera de la celda repele la hélice, manteniendo el canal en su estado cerrado.
En general, la parte de detección de voltaje del canal iónico es responsable de la detección de cambios en el potencial transmembrana que desencadenan la apertura o el cierre del canal. En general, se cree que las hélices alfa S1-4 cumplen este papel. En los canales de potasio y sodio, las hélices S4 sensibles al voltaje contienen residuos de lisina o arginina cargados positivamente en motivos repetidos. [3]En su estado de reposo, la mitad de cada hélice S4 está en contacto con el citosol celular. Tras la despolarización, los residuos cargados positivamente en los dominios S4 se mueven hacia la superficie exoplasmática de la membrana. Se cree que las primeras 4 argininas explican la corriente de activación, que se mueve hacia el disolvente extracelular tras la activación del canal en respuesta a la despolarización de la membrana. El movimiento de 10 a 12 de estas cargas positivas unidas a proteínas desencadena un cambio conformacional que abre el canal. [4] El mecanismo exacto por el cual ocurre este movimiento no está acordado actualmente, sin embargo los modelos canónico, transportador, remo y retorcido son ejemplos de teorías actuales. [7]
El movimiento del sensor de voltaje desencadena un cambio conformacional de la puerta de la vía de conducción, controlando el flujo de iones a través del canal. [3]
La parte funcional principal del dominio proteico sensible al voltaje de estos canales generalmente contiene una región compuesta por hélices S3b y S4, conocida como "paleta" debido a su forma, que parece ser una secuencia conservada , intercambiable a través de una amplia variedad de células y especies. También se ha encontrado una paleta de sensor de voltaje similar en una familia de fosfatasas sensibles al voltaje en varias especies. [8] La ingeniería genética de la región de la paleta a partir de una especie de arqueobacterias que habitan en un volcán en canales de potasio del cerebro de rata da como resultado un canal iónico completamente funcional, siempre que se reemplace toda la paleta intacta. [9] Esta " modularidad"permite el uso de sistemas modelo simples y económicos para estudiar la función de esta región, su papel en la enfermedad y el control farmacéutico de su comportamiento en lugar de limitarse a preparaciones poco caracterizadas, costosas y / o difíciles de estudiar. [10]
Aunque los canales iónicos dependientes de voltaje se activan típicamente por despolarización de la membrana , algunos canales, como los canales iónicos de potasio rectificadores hacia adentro , se activan en cambio por hiperpolarización .
Se cree que la puerta está acoplada a las regiones de detección de voltaje de los canales y parece contener una obstrucción mecánica al flujo de iones. [11] Si bien se ha acordado que el dominio S6 es el segmento que actúa como esta obstrucción, se desconoce su mecanismo exacto. Las posibles explicaciones incluyen: el segmento S6 hace un movimiento similar a una tijera que permite que los iones fluyan a través, [12] el segmento S6 se rompe en dos segmentos permitiendo el paso de iones a través del canal, [13] o el canal S6 que actúa como la puerta en sí . [14] Aún se desconoce el mecanismo por el cual el movimiento del segmento S4 afecta al del S6, sin embargo se teoriza que existe un enlazador S4-S5 cuyo movimiento permite la apertura de S6. [3]
La inactivación de los canales iónicos ocurre en milisegundos después de la apertura. Se cree que la inactivación está mediada por una puerta intracelular que controla la apertura del poro en el interior de la célula. [15] Esta puerta se modela como una bola atada a una cadena flexible . Durante la inactivación, la cadena se pliega sobre sí misma y la bola bloquea el flujo de iones a través del canal. [16] La inactivación rápida está directamente relacionada con la activación causada por los movimientos intramembrana de los segmentos S4, [17] aunque se desconoce el mecanismo que vincula el movimiento de S4 y la activación de la puerta de inactivación.
Diferentes tipos [ editar ]
Canales de sodio (Na + ) [ editar ]
Los canales de sodio tienen propiedades funcionales similares en muchos tipos de células diferentes. Si bien se han identificado diez genes humanos que codifican los canales de sodio, su función se conserva típicamente entre especies y diferentes tipos de células. [17]
Canales de calcio (Ca 2+ ) [ editar ]
Con dieciséis genes diferentes identificados para los canales de calcio humanos, este tipo de canal difiere en función entre los tipos de células. Los canales de Ca 2+ producen potenciales de acción de manera similar a los canales de Na + en algunas neuronas. También juegan un papel en la liberación de neurotransmisores en las terminaciones nerviosas presinápticas . En la mayoría de las células, los canales de Ca 2+ regulan una amplia variedad de procesos bioquímicos debido a su papel en el control de las concentraciones intracelulares de Ca 2+ . [13]
Canales de potasio (K + ) [ editar ]
Los canales de potasio son la clase más grande y diversa de canales activados por voltaje, con más de 100 genes humanos que codifican. Estos tipos de canales difieren significativamente en sus propiedades de activación; algunos se inactivan extremadamente lentamente y otros se inactivan extremadamente rápido. Esta diferencia en el tiempo de activación influye en la duración y la velocidad de disparo del potencial de acción, lo que tiene un efecto significativo en la conducción eléctrica a lo largo de un axón, así como en la transmisión sináptica. Los canales de potasio difieren en estructura de los otros canales en que contienen cuatro subunidades polipeptídicas separadas, mientras que los otros canales contienen cuatro dominios homólogos pero en una sola unidad polipeptídica. [7]
Canales de cloruro (Cl - ) [ editar ]
Los canales de cloruro están presentes en todo tipo de neuronas. Con la responsabilidad principal de controlar la excitabilidad, los canales de cloruro contribuyen al mantenimiento del potencial de reposo celular y ayudan a regular el volumen celular. [1]
Canales de protones (H + ) [ editar ]
Los canales de protones activados por voltaje transportan corrientes mediadas por iones de hidrógeno en forma de hidronio , y se activan por despolarización de una manera dependiente del pH . Funcionan para eliminar el ácido de las células. [18] [19] [20]
Filogenética [ editar ]
Los estudios filogenéticos de proteínas expresadas en bacterias revelaron la existencia de una superfamilia de canales de sodio activados por voltaje. [21] Los estudios posteriores han demostrado que una variedad de otros canales iónicos y transportadores están filogenéticamente relacionada con los canales iónicos dependientes de voltaje, incluyendo dentro rectificación de K + canales , rianodina-inositol de los receptores de Ca 1,4,5-trifosfato de + 2 canales , potencial receptor transitorio de Ca 2+ canales , canales policistina de cationes , los canales iónicos regulados por glutamato , los canales de cloruro dependientes de calcio, catión monovalente: antiportadores de protones, tipo 1 , y transportadores de potasio . [22]
Ver también [ editar ]
- Canal de potasio
- Taquicardia ventricular polimórfica catecolaminérgica
Referencias [ editar ]
- ↑ a b Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia A, McNamara JO, Williams SM (2001). "Canales de iones activados por voltaje" . Neurociencia (2ª ed.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-742-4.
- ^ Catterall WA (abril de 2000). "De las corrientes iónicas a los mecanismos moleculares: la estructura y función de los canales de sodio activados por voltaje". Neurona . 26 (1): 13-25. doi : 10.1016 / S0896-6273 (00) 81133-2 . PMID 10798388 .
- ↑ a b c d e Bezanilla F (marzo de 2005). "Canales iónicos activados por voltaje". Transacciones IEEE sobre nanociencia . 4 (1): 34–48. doi : 10.1109 / tnb.2004.842463 . PMID 15816170 .
- ↑ a b Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Sección 21.3, Propiedades moleculares de los canales de iones activados por voltaje" . Biología celular molecular (4ª ed.). Nueva York: Scientific American Books. ISBN 978-0-7167-3136-8.
- ^ Gulbis JM, Mann S, MacKinnon R (junio de 1999). "Estructura de una subunidad beta de canal de K + dependiente de voltaje ". Celular . 97 (7): 943–52. doi : 10.1016 / s0092-8674 (00) 80805-3 . PMID 10399921 .
- ^ Catterall WA (2010). "Sensores de voltaje del canal de iones: estructura, función y fisiopatología" . Neurona . 67 (6): 915-28. doi : 10.1016 / j.neuron.2010.08.021 . PMC 2950829 . PMID 20869590 .
- ↑ a b Sands Z, Grottesi A, Sansom MS (2005). "Canales iónicos activados por voltaje" . Biología actual . 15 (2): R44–7. doi : 10.1016 / j.cub.2004.12.050 . PMID 15668152 .
- ^ Murata Y, Iwasaki H, Sasaki M, Inaba K, Okamura Y (junio de 2005). "Actividad fosfoinositido fosfatasa acoplada a un sensor de voltaje intrínseco". Naturaleza . 435 (7046): 1239–43. Código Bib : 2005Natur.435.1239M . doi : 10.1038 / nature03650 . PMID 15902207 .
- ^ Alabi AA, Bahamonde MI, Jung HJ, Kim JI, Swartz KJ (noviembre de 2007). "Portabilidad de la función de motivo de paleta y farmacología en sensores de voltaje" . Naturaleza . 450 (7168): 370–5. Código bibliográfico : 2007Natur.450..370A . doi : 10.1038 / nature06266 . PMC 2709416 . PMID 18004375 .
- ^ Long SB, Tao X, Campbell EB, MacKinnon R (noviembre de 2007). "Estructura atómica de un canal de K + dependiente de voltaje en un entorno similar a una membrana lipídica". Naturaleza . 450 (7168): 376–82. Código Bib : 2007Natur.450..376L . doi : 10.1038 / nature06265 . PMID 18004376 .
- ^ Yellen G (agosto de 1998). "Las partes móviles de los canales iónicos activados por voltaje". Reseñas trimestrales de biofísica . 31 (3): 239–95. doi : 10.1017 / s0033583598003448 . PMID 10384687 .
- ^ Perozo E, Cortes DM, Cuello LG (julio de 1999). "Reordenamientos estructurales subyacentes a la compuerta de activación del canal de K + " . Ciencia . 285 (5424): 73–8. doi : 10.1126 / science.285.5424.73 . PMID 10390363 .
- ^ a b Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R (mayo de 2002). "Estructura cristalina y mecanismo de un canal de potasio dependiente del calcio". Naturaleza . 417 (6888): 515–22. Código Bibliográfico : 2002Natur.417..515J . doi : 10.1038 / 417515a . PMID 12037559 .
- ^ Webster SM, Del Camino D, Dekker JP, Yellen G (abril de 2004). "Apertura de puerta intracelular en canales Shaker K + definidos por puentes metálicos de alta afinidad". Naturaleza . 428 (6985): 864–8. Código Bibliográfico : 2004Natur.428..864W . doi : 10.1038 / nature02468 . PMID 15103379 .
- ^ Armstrong CM (julio de 1981). "Canales de sodio y corrientes de compuerta". Revisiones fisiológicas . 61 (3): 644–83. doi : 10.1152 / physrev.1981.61.3.644 . PMID 6265962 .
- ^ Vassilev P, Scheuer T, Catterall WA (octubre de 1989). "Inhibición de la inactivación de canales de sodio individuales por un anticuerpo dirigido al sitio" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 86 (20): 8147–51. Código Bibliográfico : 1989PNAS ... 86.8147V . doi : 10.1073 / pnas.86.20.8147 . PMC 298232 . PMID 2554301 .
- ↑ a b Bénitah JP, Chen Z, Balser JR, Tomaselli GF, Marbán E (marzo de 1999). "La dinámica molecular del poro del canal de sodio varía con la compuerta: interacciones entre los movimientos del segmento P y la inactivación" . La Revista de Neurociencia . 19 (5): 1577–85. doi : 10.1523 / JNEUROSCI.19-05-01577.1999 . PMC 6782169 . PMID 10024345 .
- ^ Cherny, VV; Markin, VS; DeCoursey, TE (1995), "La conductancia de iones de hidrógeno activado por voltaje en células epiteliales alveolares de rata está determinada por el gradiente de pH", Journal of General Physiology (publicado en junio de 1995), 105 (6), págs. 861–896, doi : 10.1085 / jgp.105.6.861 , PMC 2216954 , PMID 7561747
- ^ DeCoursey, TE (2003), "Canales de protones activados por voltaje y otras vías de transferencia de protones", Revisiones fisiológicas , 83 (2), págs. 475–579, doi : 10.1152 / physrev.00028.2002 , OCLC 205658168 , PMID 12663866
- ^ Ramsey, I. Scott; Mokrab, Younes; Carvacho, Ingrid; Sands, Zara A .; Sansom, Mark SP; Clapham, David E. (2010). "Una vía de permeación acuosa de H + en el canal de protones Hv1 dependiente de voltaje" . Naturaleza Biología Molecular y Estructural . 17 (7): 869–875. doi : 10.1038 / nsmb.1826 . PMC 4035905 . PMID 20543828 .
- ^ Koishi R, Xu H, Ren D, Navarro B, Spiller BW, Shi Q, Clapham DE (marzo de 2004). "Una superfamilia de canales de sodio activados por voltaje en bacterias" . La Revista de Química Biológica . 279 (10): 9532–8. doi : 10.1074 / jbc.M313100200 . PMID 14665618 .
- ^ Chang, Abraham B .; Lin, Ron; Studley, W. Keith; Tran, Can V .; Saier, Milton H., Jr. (2004). "Filogenia como guía para la estructura y función de las proteínas de transporte de membrana". Mol Membr Biol . 21 (3): 171–181. doi : 10.1080 / 09687680410001720830 . PMID 15204625 .
Enlaces externos [ editar ]
- Subunidades de canal iónico reguladas por voltaje IUPHAR-DB
- Compendio IUPHAR de canales de iones controlados por voltaje 2005
- Canales + aniones + dependientes del voltaje en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .