Espectroscopia de absorción
La espectroscopia de absorción se refiere a las técnicas espectroscópicas que miden la absorción de radiación , en función de la frecuencia o la longitud de onda , debido a su interacción con una muestra. La muestra absorbe energía, es decir, fotones, del campo radiante. La intensidad de la absorción varía en función de la frecuencia, y esta variación es el espectro de absorción . La espectroscopia de absorción se realiza a través del espectro electromagnético .
La espectroscopia de absorción se emplea como una herramienta de química analítica para determinar la presencia de una sustancia en particular en una muestra y, en muchos casos, para cuantificar la cantidad de sustancia presente. La espectroscopia infrarroja y ultravioleta-visible son particularmente comunes en aplicaciones analíticas. La espectroscopia de absorción también se emplea en estudios de física molecular y atómica, espectroscopia astronómica y teledetección.
Existe una amplia gama de enfoques experimentales para medir los espectros de absorción. La disposición más común es dirigir un haz de radiación generado hacia una muestra y detectar la intensidad de la radiación que pasa a través de ella. La energía transmitida se puede utilizar para calcular la absorción. La fuente, la disposición de la muestra y la técnica de detección varían significativamente según el rango de frecuencia y el propósito del experimento.
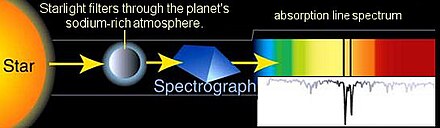
El espectro de absorción de un material es la fracción de radiación incidente absorbida por el material en un rango de frecuencias de radiación electromagnética. El espectro de absorción está determinado principalmente [2] [3] [4] por la composición atómica y molecular del material. Es más probable que la radiación se absorba a frecuencias que coincidan con la diferencia de energía entre dos estados mecánicos cuánticos de las moléculas. La absorción que ocurre debido a una transición entre dos estados se denomina línea de absorción y un espectro generalmente se compone de muchas líneas.
Las frecuencias en las que se producen las líneas de absorción, así como sus intensidades relativas, dependen principalmente de la estructura electrónica y molecular de la muestra. Las frecuencias también dependerán de las interacciones entre las moléculas de la muestra, la estructura cristalina en los sólidos y varios factores ambientales (p. ej., temperatura , presión , campo electromagnético ). Las líneas también tendrán un ancho y una forma que están determinados principalmente por la densidad espectral o la densidad de estados del sistema.
Las líneas de absorción se clasifican típicamente por la naturaleza del cambio mecánico cuántico inducido en la molécula o átomo. Las líneas de rotación , por ejemplo, se producen cuando cambia el estado de rotación de una molécula. Las líneas rotacionales se encuentran típicamente en la región espectral de microondas. Las líneas vibratorias corresponden a cambios en el estado vibratorio de la molécula y normalmente se encuentran en la región infrarroja. Las líneas electrónicas corresponden a un cambio en el estado electrónico de un átomo o molécula y normalmente se encuentran en la región visible y ultravioleta. Las absorciones de rayos X están asociadas con la excitación de los electrones de la capa interna de los átomos. Estos cambios también se pueden combinar (por ejemplo , transiciones de rotación-vibración), lo que lleva a nuevas líneas de absorción en la energía combinada de los dos cambios.