| Carbonato deshidratasa | ||||||||
|---|---|---|---|---|---|---|---|---|
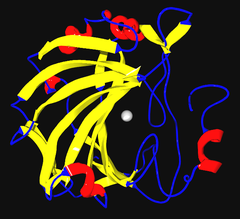 Diagrama de cinta de la anhidrasa carbónica humana II, con iones de zinc visibles en el centro | ||||||||
| Identificadores | ||||||||
| CE no. | 4.2.1.1 | |||||||
| No CAS. | 9001-03-0 | |||||||
| Bases de datos | ||||||||
| IntEnz | Vista IntEnz | |||||||
| BRENDA | Entrada BRENDA | |||||||
| FÁCIL | NiceZyme vista | |||||||
| KEGG | Entrada KEGG | |||||||
| MetaCyc | camino metabólico | |||||||
| PRIAM | perfil | |||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | |||||||
| Ontología de genes | AmiGO / QuickGO | |||||||
| ||||||||
| Anhidrasa carbónica de tipo eucariota | ||||||||
|---|---|---|---|---|---|---|---|---|
| Identificadores | ||||||||
| Símbolo | Carb_anhidrasa | |||||||
| Pfam | PF00194 | |||||||
| InterPro | IPR001148 | |||||||
| PROSITE | PDOC00146 | |||||||
| SCOP2 | 1 lata / SCOPe / SUPFAM | |||||||
| Membranome | 333 | |||||||
| ||||||||
Las anhidrasas carbónicas (o carbonato deshidratasas ) forman una familia de enzimas que catalizan la interconversión entre el dióxido de carbono y el agua y los iones disociados de ácido carbónico (es decir, iones bicarbonato e hidrógeno ). [1] El sitio activo de la mayoría de las anhidrasas carbónicas contiene un ion zinc . Por tanto, se clasifican como metaloenzimas . La enzima mantiene el equilibrio ácido-base y ayuda a transportar el dióxido de carbono. [2]
La anhidrasa carbónica ayuda a mantener la homeostasis ácido-base , regula el pH y el equilibrio de líquidos. Dependiendo de su ubicación, el papel de la enzima cambia ligeramente. Por ejemplo, la anhidrasa carbónica produce ácido en el revestimiento del estómago. En el riñón, el control de los iones de bicarbonato influye en el contenido de agua de la célula. El control de los iones de bicarbonato también influye en el contenido de agua en los ojos. Los inhibidores de la anhidrasa carbónica se utilizan para tratar el glaucoma, la acumulación excesiva de agua en los ojos. El bloqueo de esta enzima cambia el equilibrio de fluidos en los ojos del paciente para reducir la acumulación de fluidos, aliviando así la presión. [2] [3]
El efecto Bohr es una forma de describir la afinidad de unión al oxígeno de la hemoglobina. El efecto Bohr fue descrito por Christian Bohr en el año 1904 y se refiere a un cambio en una curva de disociación del oxígeno que es causado por un cambio en la concentración de dióxido de carbono o un cambio en el pH. Esencialmente, un aumento en el dióxido de carbono da como resultado un pH sanguíneo más bajo, lo que reduce la unión de oxígeno-hemoglobina. [4] Lo contrario es cierto cuando una disminución en la concentración de dióxido de carbono aumenta el pH de la sangre, lo que aumenta la tasa de unión de oxígeno-hemoglobina. Relacionar el efecto Bohr con la anhidrasa carbónica es simple: la anhidrasa carbónica acelera la reacción del dióxido de carbono que reacciona con el agua para producir iones de hidrógeno (protones) e iones de bicarbonato.
Para describir el equilibrio en la reacción de la anhidrasa carbónica, se utiliza el principio de Le Chatelier. Los tejidos son más ácidos que los pulmones porque el dióxido de carbono se produce por la respiración celular y reacciona con el agua en los tejidos para producir los protones de hidrógeno. Debido a que la concentración de dióxido de carbono es mayor, el equilibrio se desplaza hacia la derecha, hacia el lado del bicarbonato. Lo contrario se ve en los pulmones donde se libera dióxido de carbono, por lo que su concentración es menor, por lo que el equilibrio se desplaza hacia la izquierda hacia el dióxido de carbono para intentar aumentar su concentración. [5]
Antecedentes [ editar ]
Una enzima es una sustancia que actúa como catalizador en los organismos vivos y ayuda a acelerar las reacciones químicas. [6] La anhidrasa carbónica es una enzima importante que se encuentra en los glóbulos rojos, la mucosa gástrica, las células pancreáticas e incluso los túbulos renales. Es una enzima muy antigua que se descubrió en el año 1932 y se ha categorizado en tres clases generales. [7] La clase uno es la anhidrasa alfa carbónica que se encuentra en los mamíferos, la clase dos es la anhidrasa beta carbónica que se encuentra en bacterias y plantas y, por último, la clase tres es la anhidrasa gamma carbónica que se encuentra en las bacterias metanógenas de las aguas termales. [8]Las tres clases de anhidrasa carbónica tienen todas el mismo sitio activo con un centro de metal Zn, sin embargo, no son estructuralmente similares entre sí. El papel principal de la anhidrasa carbónica en los seres humanos es catalizar la conversión de dióxido de carbono en ácido carbónico y viceversa. Sin embargo, también puede ayudar con el transporte de CO 2 en la sangre, lo que a su vez ayuda a la respiración. Incluso puede funcionar en la formación de ácido clorhídrico por el estómago. [6] Por lo tanto, el papel de la anhidrasa carbónica depende de dónde se encuentre en el cuerpo.
Reacción [ editar ]
La reacción que muestra la catalización de la anhidrasa carbónica en nuestros tejidos es:
- CO 2 + H 2 O H
2CO
3 H + + HCO-
3
La catalización de la anhidrasa carbónica en los pulmones se muestra mediante:
- H + + HCO-
3 H
2CO
3 CO 2 + H 2 O
La razón por la que las reacciones son en direcciones opuestas para los tejidos y los pulmones se debe a los diferentes niveles de pH que se encuentran en ellos. Sin el catalizador de anhidrasa carbónica, la reacción es muy lenta, sin embargo, con el catalizador la reacción es 107 veces más rápida.
La reacción catalizada por la anhidrasa carbónica es:
- HCO-
3+ H + CO 2 + H 2 O
El ácido carbónico tiene un pK a de alrededor de 6,36 (el valor exacto depende del medio), por lo que a pH 7 se protona un pequeño porcentaje del bicarbonato.
La anhidrasa carbónica es una de las enzimas más rápidas y su velocidad suele estar limitada por la velocidad de difusión de sus sustratos . Las velocidades catalíticas típicas de las diferentes formas de esta enzima oscilan entre 10 4 y 10 6 reacciones por segundo. [9]
La reacción inversa no catalizada es relativamente lenta (cinética en el rango de 15 segundos). Es por eso que una bebida carbonatada no se desgasifica instantáneamente al abrir el recipiente; sin embargo, se desgasificará rápidamente en la boca cuando entre en contacto con la anhidrasa carbónica contenida en la saliva. [10]
Una anhidrasa se define como una enzima que cataliza la eliminación de una molécula de agua de un compuesto, por lo que es esta reacción "inversa" la que le da a la anhidrasa carbónica su nombre, porque elimina una molécula de agua del ácido carbónico.
En los pulmones, la anhidrasa carbónica convierte el bicarbonato en dióxido de carbono, adecuado para la exhalación.
Mecanismo [ editar ]
Un grupo protésico de zinc en la enzima está coordinado en tres posiciones por cadenas laterales de histidina . El cuarto puesto de coordinación lo ocupa el agua . Una cuarta histidina está cerca del ligando de agua, lo que facilita la formación del centro Zn-OH, que se une al CO 2 para dar un bicarbonato de zinc. [11] La construcción es un ejemplo de catálisis general ácida - básica (consulte el artículo " Catálisis ácida "). El sitio activo también cuenta con un bolsillo adecuado para el dióxido de carbono, acercándolo al grupo hidróxido.
Familias [ editar ]
La anhidrasa carbónica se encontró inicialmente en los glóbulos rojos de las vacas. [2]
Se reconocen al menos cinco familias distintas de CA: α, β, γ, δ y ζ. Estas familias no tienen una similitud significativa en la secuencia de aminoácidos y, en la mayoría de los casos, se cree que son un ejemplo de evolución convergente . Las α-CA se encuentran en humanos.
α-CA [ editar ]
Los vertebrados , las algas y algunas bacterias tienen esta familia de AC.
Las enzimas CA que se encuentran en los mamíferos se dividen en cuatro subgrupos amplios, [12] que, a su vez, constan de varias isoformas:
- los CA citosólicos (CA-I, CA-II , CA-III, CA-VII y CA XIII) ( CA1 , CA2 , CA3 , CA7 , CA13 )
- AC mitocondriales (CA-VA y CA-VB) ( CA5A , CA5B )
- CA secretadas (CA-VI) ( CA6 )
- AC asociados a la membrana (CA-IV, CA-IX, CA-XII, CA-XIV y CA-XV) ( CA4 , CA9 , CA12 , CA14 )
Hay tres isoformas de anhidrasa carbónica humana "catalíticas" adicionales ( CA-VIII , CA-X y CA-XI ) ( CA8 , CA10 , CA11 ) cuyas funciones siguen sin estar claras. [13]
| Isoforma | Gene | Masa molecular [15] (kDa) | Localización | Actividad específica de las enzimas humanas , [a] [16] (s −1 ) | Sensibilidad a las sulfonamidas , [b] K I (nM) [16] | |
|---|---|---|---|---|---|---|
| Célula | Tejido [15] | |||||
| CA-I | CA1 | 29 | citosol | glóbulos rojos y tracto gastrointestinal | 2,0 × 10 5 | 250 |
| CA-II | CA2 | 29 | citosol | casi omnipresente | 1,4 × 10 6 | 12 |
| CA-III | CA3 | 29 | citosol | 8% de proteína soluble en músculo tipo I | 1,3 × 10 4 | 240000 |
| CA-IV | CA4 | 35 | extracelular ligado a GPI | Tracto gastrointestinal , riñón , endotelio | 1,1 × 10 6 | 74 |
| CA-VA | CA5A | 34,7 (previsto) | mitocondrias | hígado | 2,9 × 10 5 | 63 |
| CA-VB | CA5B | 36,4 (previsto) | mitocondrias | ampliamente distribuido | 9,5 × 10 5 | 54 |
| CA-VI | CA6 | 39–42 | secretor | saliva y leche | 3,4 × 10 5 | 11 |
| CA-VII | CA7 | 29 | citosol | ampliamente distribuido | 9,5 × 10 5 | 2.5 |
| CA-IX | CA9 | 54, 58 | asociada a la membrana celular | tracto gastrointestinal normal , varios cánceres | 1,1 × 10 6 | dieciséis |
| CA-XII | CA12 | 44 | sitio activo localizado extracelularmente | riñón , ciertos cánceres | 4,2 × 10 5 | 5.7 |
| CA-XIII [17] | CA13 | 29 | citosol | ampliamente distribuido | 1,5 × 10 5 | dieciséis |
| CA-XIV | CA14 | 54 | sitio activo localizado extracelularmente | riñón , corazón , músculo esquelético , cerebro | 3,1 × 10 5 | 41 |
| CA-XV [18] | CA15 | 34–36 | extracelular ligado a GPI | riñón , no expresado en tejidos humanos | 4,7 × 10 5 | 72 |
- ^ Excepto para el ratón CA XV.
- ^ Acetazolamida en esta tabla.
β-CA [ editar ]
La mayoría de los AC procarióticos y de cloroplasto vegetal pertenecen a la familia beta. Se han identificado dos patrones característicos de esta familia:
- C- [SA] -DSR- [LIVM] -x- [AP]
- [EQ] - [YF] -A- [LIVM] -x (2) - [LIVM] -x (4) - [LIVMF] (3) -xGHx (2) -CG
γ-CA [ editar ]
La clase gamma de CA proviene de los metanógenos , bacterias productoras de metano que crecen en aguas termales.
δ-CA [ editar ]
La clase delta de CA se ha descrito en diatomeas . Sin embargo, recientemente [19] se ha cuestionado la distinción de esta clase de AC .
ζ-CA [ editar ]
La clase zeta de CAs se produce exclusivamente en las bacterias en unos pocos quimiolitotrofos y marina cianobacterias que contienen cso- carboxisomas . [20] Análisis tridimensionales recientes [19] sugieren que ζ-CA tiene cierta semejanza estructural con β-CA, particularmente cerca del sitio del ión metálico. Por tanto, las dos formas pueden estar relacionadas de forma distante, aunque la secuencia de aminoácidos subyacente ha divergido considerablemente desde entonces.
η-CA [ editar ]
La familia eta de CA se encontró recientemente en organismos del género Plasmodium . Se trata de un grupo de enzimas que antes se pensaba que pertenecían a la familia alfa de las CA, sin embargo, se ha demostrado que las η-CA tienen características únicas, como su patrón de coordinación de iones metálicos. [21]
ι-CA [ editar ]
La clase iota es la clase más reciente de CA descrita. Se ha descubierto en la diatomea marina Thalassiosira Pseudonana , y está muy extendida entre el fitoplancton marino. [22] En las diatomeas, el ι-CA es esencial para los mecanismos de concentración de CO 2 y, a diferencia de otras clases de CA, puede utilizar manganeso en lugar de zinc como cofactor metálico. [22] Los homólogos de ι-CA también se han confirmado en bacterias gramnegativas, donde puede estar presente como una proteína homodímera. [23]
Estructura y función [ editar ]
En la naturaleza se encuentran varias formas de anhidrasa carbónica. En la forma de anhidrasa α-carbónica mejor estudiada presente en animales, el ion zinc está coordinado por los anillos de imidazol de 3 residuos de histidina , His94, His96 e His119. [24]
La función principal de la enzima en los animales es interconvertir el dióxido de carbono y el bicarbonato para mantener el equilibrio ácido-base en la sangre y otros tejidos, y ayudar a transportar el dióxido de carbono fuera de los tejidos.
Hay al menos 14 isoformas diferentes en mamíferos. Las plantas contienen una forma diferente llamada β-anhidrasa carbónica , que, desde un punto de vista evolutivo, es una enzima distinta, pero participa en la misma reacción y también usa un ion zinc en su sitio activo. En las plantas, la anhidrasa carbónica ayuda a elevar la concentración de CO 2 dentro del cloroplasto para aumentar la tasa de carboxilación de la enzima RuBisCO . Esta es la reacción que integra CO 2 en azúcares de carbono orgánico durante la fotosíntesis , y puede usar solo la forma CO 2 de carbono, no ácido carbónico o bicarbonato. [cita requerida ]
Anhidrasa carbónica que contiene cadmio [ editar ]
Se ha descubierto que las diatomeas marinas expresan una nueva forma de ζ anhidrasa carbónica. Se descubrió que T. weissflogii , una especie de fitoplancton común en muchos ecosistemas marinos, contenía anhidrasa carbónica con un ion cadmio en lugar de zinc. [25] Anteriormente, se creía que el cadmio era un metal tóxico sin función biológica alguna. Sin embargo, esta especie de fitoplancton parece haberse adaptado a los bajos niveles de zinc en el océano mediante el uso de cadmio cuando no hay suficiente zinc. [26] Aunque la concentración de cadmio en el agua de mar también es baja (alrededor de 1x10 -16 molar), existe una ventaja medioambiental al poder utilizar cualquiera de los dos metales, dependiendo de cuál esté más disponible en ese momento. Por lo tanto, este tipo de anhidrasa carbónica es cambialista, lo que significa que puede intercambiar el metal en su sitio activo con otros metales (a saber, zinc y cadmio). [27]
Similitudes con otras anhidrasas carbónicas [ editar ]
El mecanismo de la anhidrasa carbónica de cadmio (CDCA) es esencialmente el mismo que el de otras anhidrasas carbónicas en su conversión de dióxido de carbono y agua en bicarbonato y un protón. [28] Además, al igual que las otras anhidrasas carbónicas, el CDCA hace que la reacción sea casi tan rápida como la velocidad de difusión de sus sustratos, y puede ser inhibida por derivados de sulfonamida y sulfamato . [28]
Diferencias con otras anhidrasas carbónicas [ editar ]
A diferencia de la mayoría de las otras anhidrasas carbónicas, el ión metálico del sitio activo no está unido por tres residuos de histidina y un ión hidróxido. En cambio, está unido por dos residuos de cisteína , un residuo de histidina y un ión hidróxido, que es característico de β-CA. [28] [29] Debido al hecho de que el cadmio es un ácido blando , estará más unido por ligandos de base blanda . [27] Los átomos de azufre en los residuos de cisteína son bases blandas, por lo que unen el cadmio más fuertemente que el nitrógeno en los residuos de histidina. CDCA también tiene una estructura de plegado tridimensional que es diferente a cualquier otra anhidrasa carbónica, y su secuencia de aminoácidos es diferente a las otras anhidrasas carbónicas.[28] Es un monómero con tres dominios, cada uno idéntico en la secuencia de aminoácidos y cada uno contiene un sitio activo con un ion metálico. [29]
Otra diferencia clave entre el CDCA y las otras anhidrasas carbónicas es que el CDCA tiene un mecanismo para cambiar su ion cadmio por un ion zinc en caso de que el zinc esté más disponible para el fitoplancton que el cadmio. El sitio activo de CDCA está esencialmente "controlado" por una cadena de nueve aminoácidos con residuos de glicina en las posiciones 1 y 9. Normalmente, esta puerta permanece cerrada y el ión cadmio queda atrapado en su interior. Sin embargo, debido a la flexibilidad y la posición de los residuos de glicina, esta puerta se puede abrir para eliminar el ion cadmio. Luego se puede colocar un ion de zinc en su lugar y la puerta se cerrará detrás de él. [28] Como ácido limítrofe, el zinc no se unirá tan fuertemente a los ligandos de cisteína como lo haría el cadmio, pero la enzima seguirá estando activa y razonablemente eficiente. El metal en el sitio activo se puede cambiar entre zinc y cadmio dependiendo de cuál sea más abundante en ese momento. Es la capacidad de CDCA para utilizar cadmio o zinc lo que probablemente le da a T. weissflogii una ventaja de supervivencia. [26]
Transporte de cadmio [ editar ]
El cadmio todavía se considera letal para el fitoplancton en grandes cantidades. Los estudios han demostrado que T. weissflogii tiene una respuesta tóxica inicial al cadmio cuando se expone a él. La toxicidad del metal se reduce mediante la transcripción y traducción de fitoquelatina , que son proteínas que pueden unirse y transportar cadmio. Una vez que se une a la fitoquelatina, el cadmio ya no es tóxico y puede transportarse de manera segura a la enzima CDCA. [25] También se ha demostrado que la absorción de cadmio a través de la fitoquelatina conduce a un aumento significativo en la expresión de CDCA. [25]
Proteínas similares a CDCA [ editar ]
Se ha analizado la presencia de CDCA en otros fitoplancton de diferentes fuentes de agua. Se encontró que muchos de ellos contienen proteínas que son homólogas al CDCA que se encuentra en T. weissflogii . [25] Esto incluye especies de Great Bay, Nueva Jersey , así como en el Océano Pacífico cerca del ecuador . En todas las especies probadas, las proteínas similares a CDCA mostraron altos niveles de expresión incluso en altas concentraciones de zinc y en ausencia de cadmio. [25] La similitud entre estas proteínas y el CDCA expresado por T. weissflogii varió, pero siempre fueron al menos un 67% similares. [25]
Captura y secuestro de carbono [ editar ]
En principio, la anhidrasa carbónica podría resultar relevante para la captura de carbono . Algunas anhidrasas carbónicas pueden soportar temperaturas de hasta 107 ° C y alcalinidad extrema (pH> 10). [30] Una prueba piloto con el CA más estable en una corriente de combustión que constaba de 12-13% de composición en moles de CO₂ tuvo una tasa de captura del 63,6% durante un período de 60 horas sin efectos notables en el rendimiento de la enzima. El CA se colocó en una solución de N-metildietanolamina (MDEA) donde sirvió para aumentar la diferencia de concentración (fuerza motriz) de CO 2 entre la corriente de combustión de la central eléctrica y la fase líquida en un contactor líquido-gas. [30]
Ver también [ editar ]
- Inhibidor de la anhidrasa carbónica
Referencias [ editar ]
- ↑ Badger MR, Price GD (1994). "El papel de la anhidrasa carbónica en la fotosíntesis". Annu. Rev. Plant Physiol. Plant Mol. Biol . 45 : 369–392. doi : 10.1146 / annurev.pp.45.060194.002101 .
- ^ a b c "PDB101: Molécula del mes: anhidrasa carbónica" . RCSB: PDB-101 . Consultado el 3 de diciembre de 2018 .
- ^ Supuran CT (27 de mayo de 2004). Anhidrasas carbónicas: mecanismos catalíticos y de inhibición, distribución y funciones fisiológicas . Taylor y Francis. doi : 10.1201 / 9780203475300-5 (inactivo el 15 de enero de 2021). ISBN 9780203475300.Mantenimiento de CS1: DOI inactivo a partir de enero de 2021 ( enlace )
- ^ "Efecto Bohr" . www.pathwaymedicine.org . Consultado el 23 de noviembre de 2019 .
- ^ "Principio de Le Chatelier" . www.chemguide.co.uk . Consultado el 23 de noviembre de 2019 .
- ^ a b "Diccionario Britannica" .
- ^ Maren TH (octubre de 1967). "Anhidrasa carbónica: química, fisiología e inhibición". Revisiones fisiológicas . 47 (4): 595–781. doi : 10.1152 / physrev.1967.47.4.595 . PMID 4964060 . S2CID 19954840 .
- ^ Química inorgánica biológica. Estructura y reactividad . pp. sección IX.1.3.1. pag. 180.
- ^ Lindskog S (1997). "Estructura y mecanismo de la anhidrasa carbónica". Farmacología y terapéutica . 74 (1): 1–20. doi : 10.1016 / S0163-7258 (96) 00198-2 . PMID 9336012 .
- ^ Thatcher BJ, Doherty AE, Orvisky E, Martin BM, Henkin RI (septiembre de 1998). "Gustin de saliva parótida humana es anhidrasa carbónica VI". Comunicaciones de investigación bioquímica y biofísica . 250 (3): 635–41. doi : 10.1006 / bbrc.1998.9356 . PMID 9784398 .
- ^ Parkin G (febrero de 2004). "Análogos sintéticos relevantes para la estructura y función de las enzimas de zinc". Revisiones químicas . 104 (2): 699–767. doi : 10.1021 / cr0206263 . PMID 14871139 . S2CID 9857226 .
- ^ Breton S (julio de 2001). "La fisiología celular de las anhidrasas carbónicas" . JOP . 2 (4 Suppl): 159–64. PMID 11875253 .
- ^ Lovejoy DA, Hewett-Emmett D, Porter CA, Cepoi D, Sheffield A, Vale WW, Tashian RE (diciembre de 1998). La proteína XI relacionada con la anhidrasa carbónica "catalítica" conservada evolutivamente contiene un motivo de secuencia presente en el neuropéptido sauvagina: el gen humano CA-RP XI (CA11) está incrustado entre el grupo de genes secretores y el gen DBP en 19q13.3 ". Genómica . 54 (3): 484–93. doi : 10.1006 / geno.1998.5585 . PMID 9878252 .
- ^ Boriack-Sjodin PA, Zeitlin S, Chen HH, Crenshaw L, Gross S, Dantanarayana A, et al. (Diciembre de 1998). "Análisis estructural de la unión del inhibidor a la anhidrasa carbónica II humana" . Ciencia de las proteínas . 7 (12): 2483–9. doi : 10.1002 / pro.5560071201 . PMC 2143894 . PMID 9865942 .
- ^ a b A menos que se especifique lo contrario: Boron WF (2005). Fisiología médica: un enfoque celular y molecular . Elsevier / Saunders. ISBN 978-1-4160-2328-9. Página 638
- ^ a b Hilvo M, Baranauskiene L, Salzano AM, Scaloni A, Matulis D, Innocenti A, et al. (Octubre de 2008). "Caracterización bioquímica de CA IX, una de las isoenzimas de anhidrasa carbónica más activas" . La Revista de Química Biológica . 283 (41): 27799–809. doi : 10.1074 / jbc.M800938200 . PMID 18703501 .
- ^ Lehtonen J, Shen B, Vihinen M, Casini A, Scozzafava A, Supuran CT, et al. (Enero de 2004). "Caracterización de CA XIII, un nuevo miembro de la familia de isoenzimas de la anhidrasa carbónica" . La Revista de Química Biológica . 279 (4): 2719–27. doi : 10.1074 / jbc.M308984200 . PMID 14600151 .
- ^ Hilvo M, Tolvanen M, Clark A, Shen B, Shah GN, Waheed A, et al. (Noviembre de 2005). "Caracterización de CA XV, una nueva forma de anhidrasa carbónica anclada a GPI" . La revista bioquímica . 392 (Parte 1): 83–92. doi : 10.1042 / BJ20051102 . PMC 1317667 . PMID 16083424 .
- ^ a b Sawaya MR, Cannon GC, Heinhorst S, Tanaka S, Williams EB, Yeates TO, Kerfeld CA (marzo de 2006). "La estructura de la anhidrasa beta-carbónica de la capa carboxisomal revela una subclase distinta con un sitio activo por el precio de dos" . La Revista de Química Biológica . 281 (11): 7546–55. doi : 10.1074 / jbc.M510464200 . PMID 16407248 .
- ^ Entonces AK, Espie GS, Williams EB, Shively JM, Heinhorst S, Cannon GC (febrero de 2004). "Un nuevo linaje evolutivo de anhidrasa carbónica (clase épsilon) es un componente de la capa carboxisoma" . Revista de bacteriología . 186 (3): 623-30. doi : 10.1128 / JB.186.3.623-630.2004 . PMC 321498 . PMID 14729686 .
- ^ Del Prete S, Vullo D, Fisher GM, Andrews KT, Poulsen SA, Capasso C, Supuran CT (septiembre de 2014). "Descubrimiento de una nueva familia de anhidrasas carbónicas en el patógeno de la malaria Plasmodium falciparum — las anhidrasas η-carbónicas". Cartas de Química Bioorgánica y Medicinal . 24 (18): 4389–4396. doi : 10.1016 / j.bmcl.2014.08.015 . hdl : 10072/63103 . PMID 25168745 .
- ^ a b Jensen EL, Clement R, Kosta A, Maberly SC, Gontero B (agosto de 2019). "Una nueva subclase generalizada de anhidrasa carbónica en el fitoplancton marino" . El diario ISME . 13 (8): 2094–2106. doi : 10.1038 / s41396-019-0426-8 . PMC 6776030 . PMID 31024153 .
- ^ Del Prete S, Nocentini A, Supuran CT, Capasso C (diciembre de 2020). "Burkholderia territorii" . Revista de inhibición de enzimas y química medicinal . 35 (1): 1060–1068. doi : 10.1080 / 14756366.2020.1755852 . PMC 7191908 . PMID 32314608 .
- ^ Krishnamurthy VM, Kaufman GK, Urbach AR, Gitlin I, Gudiksen KL, Weibel DB, Whitesides GM (marzo de 2008). "La anhidrasa carbónica como modelo para estudios biofísicos y físico-orgánicos de proteínas y unión proteína-ligando" . Revisiones químicas . 108 (3): 946-1051. doi : 10.1021 / cr050262p . PMC 2740730 . PMID 18335973 .
- ^ a b c d e f Park H, McGinn PJ, More FM (19 de mayo de 2008). "Expresión de anhidrasa carbónica de cadmio de diatomeas en agua de mar" . Ecología microbiana acuática . 51 : 183-193. doi : 10.3354 / ame01192 .
- ^ a b Lane TW, Saito MA, George GN, Pickering IJ, Prince RC, Morel FM (mayo de 2005). "Bioquímica: una enzima de cadmio de una diatomea marina" . Naturaleza . 435 (7038): 42. Bibcode : 2005Natur.435 ... 42L . doi : 10.1038 / 435042a . PMID 15875011 . S2CID 52819760 .
- ↑ a b Bertini I, Gray H, Stiefel E, Valentine J (2007). Química biológica inorgánica: estructura y reactividad (Primera ed.). Sausalito, California: University Science Books. ISBN 978-1-891389-43-6.
- ↑ a b c d e Sigel A, Sigel H, Sigel RK (2013). Cadmio de la toxicidad a la esencialidad . Dordrecht: Springer. ISBN 978-94-007-5179-8.
- ^ a b Xu Y, Feng L, Jeffrey PD, Shi Y, Morel FM (marzo de 2008). "Estructura e intercambio de metales en la anhidrasa carbónica de cadmio de diatomeas marinas". Naturaleza . 452 (7183): 56–61. Código Bibliográfico : 2008Natur.452 ... 56X . doi : 10.1038 / nature06636 . PMID 18322527 . S2CID 4420280 .
- ^ a b Alvizo O, Nguyen LJ, Savile CK, Bresson JA, Lakhapatri SL, Solis EO, et al. (Noviembre de 2014). "Evolución dirigida de una anhidrasa carbónica ultraestable para la captura de carbono de alta eficiencia de los gases de combustión" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 111 (46): 16436–41. Código bibliográfico : 2014PNAS..11116436A . doi : 10.1073 / pnas.1411461111 . PMC 4246266 . PMID 25368146 .
Lectura adicional [ editar ]
- Lyall V, Alam RI, Phan DQ, Ereso GL, Phan TH, Malik SA, et al. (Septiembre de 2001). "La disminución del pH intracelular de las células receptoras del gusto de la rata es el estímulo próximo en la transducción del sabor agrio" . Revista estadounidense de fisiología. Fisiología celular . 281 (3): C1005-13. doi : 10.1152 / ajpcell.2001.281.3.C1005 . PMID 11502578 .
Enlaces externos [ editar ]
- Descripción general de toda la información estructural disponible en el PDB para UniProt : P00918 (anhidrasa carbónica humana 2) en el PDBe-KB .

