Dicobalto octacarbonilo
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Octacarbonildicobalto ( Co — Co ) | |
| Otros nombres Carbonilo de cobalto, di-mu-Carbonilhexacarbonildicobalto, octacarbonilo de cobalto, dímero de tetracarbonilo de cobalto, carbonilo de dicobalto, octacarbonildicobalto | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.030.454 |
| Número CE |
|
PubChem CID | |
| Número RTECS |
|
| UNII | |
| un numero | 3281 |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| Co 2 (CO) 8 | |
| Masa molar | 341,95 g / mol |
| Apariencia | Cristales de color rojo anaranjado sólido cristalino blanco cuando está puro [1] |
| Densidad | 1,87 g / cm 3 |
| Punto de fusion | 51 a 52 ° C (124 a 126 ° F; 324 a 325 K) |
| Punto de ebullición | 52 ° C (126 ° F; 325 K) ca se descompone |
| insoluble | |
| Presión de vapor | 0,7 mmHg (20 ° C) [1] |
| Estructura | |
| 1,33 D ( isómero C 2v ) 0 D ( isómero D 3d ) | |
| Riesgos | |
| Principales peligros | Muy tóxico, desprende gas CO al descomponerse, [1] pirofórico, cancerígeno |
| Ficha de datos de seguridad | MSDS externa |
| Pictogramas GHS |     |
| Palabra de señal GHS | Peligro |
| H228 , H251 , H302 , H312 , H315 , H317 , H319 , H330 , H334 , H350 , H351 , H361 , H412 | |
| NFPA 704 (diamante de fuego) |  4 3 3 |
| punto de inflamabilidad | Pirofórico [1] |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
PEL (permitido) | ninguno [1] |
REL (recomendado) | TWA 0,1 mg / m 3 [1] |
IDLH (peligro inmediato) | ND [1] |
| Compuestos relacionados | |
Carbonilos metálicos relacionados | Hierro pentacarbonil Diiron nonacarbonil Níquel tetracarbonilo |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
Dicobalt octacarbonyl es el compuesto organometálico con composición Co 2 (CO) 8 . Este carbonilo metálico se utiliza como reactivo y catalizador en la química organometálica y la síntesis orgánica , y es fundamental para la química organocobalto muy conocida . [2] [3] Es el precursor de un catalizador de hidroformilación , hidruro de cobalto tetracarbonilo . [4] Cada molécula consta de dos átomos de cobalto unidos a ocho monóxido de carbono. ligandos , aunque se conocen múltiples disposiciones estructurales distintas. [5] Algunos de los ligandos de carbonilo son muy lábiles . El compuesto es muy reactivo con los alquinos y, a veces, se utiliza como grupo protector de alquinos . Como complejo de cobalto-alquino, juega un papel en la promoción tanto de la reacción de Nicholas [3] [6] [7] como de la reacción de Pauson-Khand . [3] [8] [9]
Síntesis, estructura, propiedades.
Dicobalt octacarbonyl es un sólido blanco cuando es de alta pureza, pero más típicamente es un sólido pirofórico de color naranja que es térmicamente inestable. [1] Se sintetiza mediante la carbonilación a alta presión de sales de cobalto (II) . En el método patentado por James Eli Knap, el acetato de cobalto (II) se calienta entre 150 y 200 ° C y se expone a gases de hidrógeno y monóxido de carbono a presiones de 2000 a 6000 psi : [10]
- 2 Co (CH 3 CO 2 ) 2 + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
La preparación a menudo se lleva a cabo en presencia de cianuro , convirtiendo la sal de cobalto (II) en un complejo de hexacianocobaltato (II) que luego se trata con monóxido de carbono para producir K [Co (CO) 4 ]. La acidificación produce hidruro de cobalto tetracarbonilo , HCo (CO) 4 , que luego se puede calentar para formar dicobalto octacarbonilo. [3] [11] También se puede preparar calentando cobalto metálico por encima de 250 ° C en una corriente de gas monóxido de carbono a aproximadamente 200 a 300 atm : [3]
- 2 Co + 8 CO → Co 2 (CO) 8
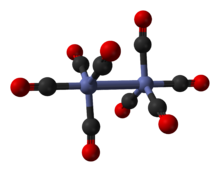
Se sabe que existe en varias formas isoméricas , todas con la misma composición - [Co 2 (CO) 8 ] - con dos centros de metal cobalto en estado de oxidación cero rodeados por ocho ligandos carbonilo (CO) . Estos ligandos pueden formar puentes entre los dos centros de cobalto o unirse a un solo centro metálico (un ligando terminal ). [2] [3] En solución, se conocen dos isómeros que se interconvierten rápidamente: [5]
El isómero principal (a la izquierda en el proceso de equilibrio anterior ) contiene dos ligandos de carbonilo puente que unen los centros de cobalto y seis ligandos de carbonilo terminales, tres en cada metal. [5] Se puede resumir en la fórmula (CO) 3 Co (μ-CO) 2 Co (CO) 3 y tiene simetría C 2v . Esta estructura se asemeja al diiron nonacarbonyl (Fe 2 (CO) 9 ) pero con un carbonilo puente menos. La distancia Co – Co es de 2,52 Å, y las distancias entre el terminal Co – CO y el puente Co – CO son 1,80 y 1,90 Å, respectivamente. [12]El análisis del enlace sugiere la ausencia de un enlace directo cobalto-cobalto. [13]
El isómero menor no tiene ligandos de carbonilo puente, sino que tiene un enlace directo entre los centros de cobalto y ocho ligandos de carbonilo terminales, cuatro en cada átomo de metal. [5] Se puede resumir en la fórmula (CO) 4 Co-Co (CO) 4 y tiene simetría D 4d . Presenta un enlace cobalto-cobalto sin puente de 2,70 Å de longitud en la estructura sólida cuando se cristaliza junto con C 60 . [14]
Reacciones
Reacción de Nicolás
La reacción de Nicholas es una reacción de sustitución mediante la cual un grupo alcoxi ubicado en el carbono α de un alquino se reemplaza por otro nucleófilo . [6] [7] El alquino reacciona primero con el dicobalto octacarbonilo, a partir del cual se genera un catión propargílico estabilizado [15] [16] que reacciona con el nucleófilo entrante y luego el producto se forma por desmetalación oxidativa . [6] [7]
Reacción de Pauson-Khand
La reacción de Pauson-Khand , [8] en la que un alquino , un alqueno y monóxido de carbono se ciclan para dar una ciclopentenona , puede ser catalizada por Co 2 (CO) 8 , [3] [9] a través de métodos más nuevos que son más eficientes desde entonces se han desarrollado: [17] [18]
El Co 2 (CO) 8 reacciona con los alquinos para formar un complejo covalente estable, que es útil como grupo protector para el alquino. Este complejo en sí mismo también se puede utilizar en la reacción de Pauson-Khand. [8]
Son posibles las reacciones intramoleculares de Pauson-Khand, en las que el material de partida contiene los restos alqueno y alquino. En la síntesis asimétrica de la Lycopodium alcaloide huperzina-Q , Takayama y compañeros de trabajo utilizado una reacción de Pauson Khand-intramolecular para ciclar un enino que contiene un terc -butildifenilsililo (TBDPS) protegido alcohol primario. [19] La preparación del resto de siloxano cíclico inmediatamente antes de la introducción del dicobalto octacarbonilo asegura que el producto se forme con la conformación deseada . [20]
Paso 1 : Disociación del monóxido de carbono del hidruro de cobalto tetracarbonilo para formar HCo (CO) 3 , el activo Especies catalíticas
Paso 2 : El centro de cobalto forma un enlace π con el alqueno
Paso 3 : El ligando de alqueno se inserta en el enlace de hidruro de cobalto
Paso 4 : Coordinación de un ligando de carbonilo adicional
Paso 5 : Inserción migratoria de un ligando de carbonilo en el enlace cobalto-alquilo, convirtiendo el intermedio de alquil tetracarbonilo en una especie de acil tricarbonilo [21]
Paso 6 : La adición oxidativa de dihidrógeno conduce a un complejo de dihidrido
Paso 7 : Producto de aldehído liberado por eliminación reductora , [22] regenerando las especies catalíticas activas
Paso 8 : Una reacción secundaria improductiva y reversible
Hidroformilación
La hidrogenación de Co 2 (CO) 8 produce hidruro de cobalto tetracarbonilo, [HCo (CO) 4 ]: [23]
- Co 2 (CO) 8 + H 2 → 2 HCo (CO) 4
Este hidruro se utiliza como catalizador para la hidroformilación , la conversión de un alqueno terminal , RCH = CH 2 , en un aldehído , RCH 2 CH 2 CHO. [4] [23] El ciclo catalítico de esta hidroformilación se muestra en el diagrama. [4] [21] [22]
La reducción de Co 2 (CO) 8 con amalgama de sodio da la base conjugada de HCo (CO) 4 . Esta sal produce el hidruro por acidificación, proporcionando una vía sintética alternativa para esa especie. [3] Las sales de esta forma también son intermediarios en la ruta de síntesis de cianuro para el octacarbonilo de dicobalto. [11]
- Co 2 (CO) 8 + 2 Na → 2 NaCo (CO) 4
- NaCo (CO) 4 + H + → HCo (CO) 4 + Na +
Los ligandos de CO se pueden reemplazar con ligandos de fosfina terciaria para dar Co 2 (CO) 8− x (PR 3 ) x . Estos voluminosos derivados son catalizadores más selectivos para reacciones de hidroformilación. [3] Las bases de Lewis " duras ", por ejemplo , piridina , causan desproporción :
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co (C 5 H 5 N) 6 ] [Co (CO) 4 ] 2 + 8 CO
Tricobalt nonacarbonilos
El calentamiento provoca descarbonilación y formación de tetracobalto dodecacarbonilo : [3] [24]
- 2 Co 2 (CO) 8 → Co 4 (CO) 12 + 4 CO
Como muchos carbonilos metálicos, el octacarbonilo de dicobalto extrae haluros de haluros de alquilo. Al reaccionar con el bromoformo , se convierte en metilidinétricobaltnonacarbonilo , HCCo 3 (CO) 9 , mediante una reacción que puede idealizarse como: [25]
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
El análisis cristalográfico de rayos X muestra que el producto contiene un triángulo de átomos de cobalto a distancias cercanas a 2,48 Å, cada uno unido a tres grupos carbonilo terminales, y con un grupo metilidino (CH) que forma el vértice de una pirámide triangular. Este producto está relacionado estructuralmente con el tetracobalto dodecacarbonilo, [26] teóricamente reemplazando el grupo metilidino por un cuarto resto Co (CO) 3 . Sin embargo, ha habido un desacuerdo entre la teoría y el experimento, demostrando que la estructura real del tetracobalto dodecacarbonilo tiene tres grupos carbonilo puente. [27] [28] [29]
La seguridad
El Co 2 (CO) 8, una fuente volátil de cobalto (0), es pirofórico y libera monóxido de carbono al descomponerse. [30] El Instituto Nacional de Seguridad y Salud Ocupacional ha recomendado que los trabajadores no deben exponerse a concentraciones superiores a 0,1 mg / m 3 durante un promedio ponderado en el tiempo de ocho horas, sin el equipo respiratorio adecuado. [31]
Referencias
- ^ a b c d e f g h Guía de bolsillo de NIOSH sobre peligros químicos. "# 0147" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ↑ a b Pauson, Peter L .; Stambuli, James P .; Chou, Teh-Chang; Hong, Bor-Cherng (2014). "Octacarbonildicobalto". Enciclopedia de reactivos para síntesis orgánica . John Wiley e hijos . doi : 10.1002 / 047084289X.ro001.pub3 .
- ^ a b c d e f g h i j Donaldson, John Dallas; Beyersmann, Detmar (2005). "Cobalto y compuestos de cobalto". Enciclopedia de química industrial de Ullmann . Wiley-VCH. doi : 10.1002 / 14356007.a07_281.pub2 .
- ↑ a b c d Elschenbroich, C .; Salzer, A. (1992). Organometálicos: una introducción concisa (2ª ed.). Weinheim: Wiley-VCH . ISBN 3-527-28165-7.
- ^ a b c d Sweany, Ray L .; Brown, Theodore L. (1977). "Espectros infrarrojos de octacarbonilo de dicobalto aislado en matriz. Evidencia del tercer isómero". Química inorgánica . 16 (2): 415–421. doi : 10.1021 / ic50168a037 .
- ↑ a b c Nicholas, Kenneth M. (1987). "Química y utilidad sintética de los cationes propargilo complejados con cobalto". Acc. Chem. Res. (Revisar). 20 (6): 207–214. doi : 10.1021 / ar00138a001 .
- ↑ a b c Teobald, Barry J. (2002). "La reacción de Nicolás: el uso de cationes propargílicos estabilizados con hexacarbonilo dicobalto en síntesis". Tetraedro (revisión). 58 (21): 4133–4170. doi : 10.1016 / S0040-4020 (02) 00315-0 .
- ^ a b c Pauson, PL ; Khand, IU (1977). "Usos de complejos de cobalto-carbonil acetileno en síntesis orgánica". Ana. NY Acad. Sci. 295 (1): 2-14. doi : 10.1111 / j.1749-6632.1977.tb41819.x .
- ↑ a b Blanco-Urgoiti, Jaime; Añorbe, Loreto; Pérez-Serrano, Leticia; Domínguez, Gema; Pérez-Castells, Javier (2004). "La reacción de Pauson-Khand, una poderosa herramienta sintética para la síntesis de moléculas complejas". Chem. Soc. Apocalipsis 33 (1): 32–42. doi : 10.1039 / b300976a .
- ^ Patente estadounidense 3236597 , Knap, James Eli, "Dicobalt Octacarbonyl de alta pureza", emitida el 22 de febrero de 1966, asignada a Union Carbide Corporation
- ↑ a b Orchin, Milton (1953). "Hidrogenación de compuestos orgánicos con gas de síntesis". Avances en Catálisis . 5 . Prensa académica . págs. 385–415. ISBN 9780080565095.
- ^ Sumner, G. Gardner; Klug, Harold P .; Alexander, Leroy E. (1964). "La estructura cristalina del dicobalto octacarbonilo". Acta Crystallographica . 17 (6): 732–742. doi : 10.1107 / S0365110X64001803 .
- ↑ Green, Jennifer C .; Verde, Malcolm LH ; Parkin, Gerard (2012). "La aparición y representación de enlaces de dos electrones de tres centros en compuestos inorgánicos covalentes". Comunicaciones químicas . 2012 (94): 11481–11503. doi : 10.1039 / c2cc35304k .
- ^ García, Thelma Y .; Fettinger, James C .; Olmstead, Marilyn M .; Balch, Alan L. (2009). "Simetría espléndida: cristalización de un isómero sin puente de Co 2 (CO) 8 en Co 2 (CO) 8 · C 60 ". Comunicaciones químicas . 2009 (46): 7143–7145. doi : 10.1039 / b915083h .
- ^ Lockwood, Rosa F .; Nicolás, Kenneth M. (1977). "Iones carbenio estabilizados con metales de transición como intermedios sintéticos. I. iones α - [(alquinil) dicobalto hexacarbonil] carbenio como agentes propargilantes". Tetrahedron Lett. 18 (48): 4163–4165. doi : 10.1016 / S0040-4039 (01) 83455-9 .
- ^ Nicolás, KM; Pettit, R. (1972). "Sobre la estabilidad de los iones de α- (alquinil) dicobalto hexacarbonil carbonio". J. Organomet. Chem. 44 (1): C21 – C24. doi : 10.1016 / 0022-328X (72) 80037-8 .
- ^ Schore, Neil E. (1991). "La reacción de cicloadición de Pauson-Khand para la síntesis de ciclopentenonas". Org. Reaccionar. 40 : 1. doi : 10.1002 / 0471264180.or040.01 .
- ^ Gibson, Susan E .; Stevenazzi, Andrea (2003). "La reacción de Pauson-Khand: ¡Ha llegado la edad catalítica!". Angew. Chem. En t. Ed. 42 (16): 1800–1810. doi : 10.1002 / anie.200200547 .
- ^ Nakayama, Atsushi; Kogure, Noriyuki; Kitajima, Mariko; Takayama, Hiromitsu (2011). "Síntesis total asimétrica de un alcaloide de licopodio pentacíclico : Huperzine-Q". Angew. Chem. En t. Ed. 50 (35): 8025–8028. doi : 10.1002 / anie.201103550 .
- ↑ Ho, Tse-Lok (2016). "Dicobalt Octacarbonyl" . Reactivos de Fiesers para síntesis orgánica . 28 . John Wiley e hijos . págs. 251-252. ISBN 9781118942819.
- ^ a b Diablos, Richard F .; Breslow, David S. (1961). "La reacción del hidrotetracarbonilo de cobalto con olefinas". Revista de la Sociedad Química Estadounidense . 83 (19): 4023–4027. doi : 10.1021 / ja01480a017 .
- ↑ a b Halpern, Jack (2001). "Química organometálica en el umbral de un nuevo milenio. Retrospectiva y prospectiva" . Química pura y aplicada . 73 (2): 209–220. doi : 10.1351 / pac200173020209 .
- ↑ a b Pfeffer, M .; Grellier, M. (2007). "Organometálicos de cobalto". Química Organometálica Integral III . 7 . Elsevier . págs. 1-119. doi : 10.1016 / B0-08-045047-4 / 00096-0 .
- ^ Chini, P. (1968). "Los racimos de carbonilo metálicos cerrados". Reseñas de Inorganica Chimica Acta . 2 : 31–51. doi : 10.1016 / 0073-8085 (68) 80013-0 .
- ^ Nestlé, Mara O .; Hallgren, John E .; Seyferth, Dietmar; Dawson, Peter; Robinson, Brian H. (1980). "μ 3- Metilidina y μ 3 -Bencilidina-Tris (Tricarbonilcobalto)". Inorg. Synth. 20 : 226-229. doi : 10.1002 / 9780470132517.ch53 .
- ^ Leung, P .; Coppens, P .; McMullan, RK; Koetzle, TF (1981). "La estructura de Nonacarbonyl-μ 3 -methylidyne- triangulo -tricobalt. Estudios de difracción de neutrones y rayos X". Acta Crystallogr. B . 37 (7): 1347-1352. doi : 10.1107 / S0567740881005906 .
- ^ Corradini, Paolo (1959). "Estructura del tetracobaltodecarbonilo". Revista de Física Química . 31 (6): 1676-1677. doi : 10.1063 / 1.1730674 .
- ^ Wei, Chin Hsuan (1969). "Análisis estructural de tetracobalto dodecacarbonilo y tetrarodio dodecacarbonilo. Tratamientos cristalográficos de una estructura desordenada y un composite maclado". Química inorgánica . 8 (11): 2384–2397. doi : 10.1021 / ic50081a030 .
- ^ Farrugia, Louis J .; Braga, Darío; Grepioni, Fabrizia (1999). "Una estructura de redeterminación de Co 4 (CO) 12 : evidencia de desorden dinámico y la vía de migración del átomo metálico en la fase cristalina". Revista de Química Organometálica . 573 (1–2): 60–66. doi : 10.1016 / S0022-328X (98) 00879-1 .
- ^ Ficha de datos de seguridad (MSDS) de Cole Parmer
- ^ CDC - Guía de bolsillo de NIOSH sobre peligros químicos
- Complejos de carbonilo
- Compuestos de organocobalto
- Compuestos químicos que contienen enlaces metal-metal