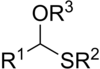
tioacetal
Los tioacetales son los análogos de azufre de los acetales . Hay dos clases: monotioacetales y ditioacetales. Los monotioacetales son menos comunes, tienen el grupo funcional RC(OR')(SR")H. Los ditioacetales tienen la fórmula RC(SR') 2 H (ditioacetales simétricos) y RC(SR')(SR")H (ditioacetales asimétricos) . [1]
Los ditioacetales simétricos son relativamente comunes. Se preparan por condensación de tioles o ditioles con aldehídos. Estas reacciones proceden a través de la intermediación de los hemitioacetales :
Los ditioacetales generados a partir de aldehídos y 1,2-etanoditiol o 1,3-propanoditiol son especialmente comunes entre esta clase de moléculas para uso en síntesis orgánica . [2]
El carbono carbonílico de un aldehído es electrofílico y, por lo tanto, susceptible de ser atacado por nucleófilos , mientras que el carbono central análogo de un ditioacetal no es electrofílico. Como resultado, los ditioacetales pueden servir como grupos protectores para los aldehídos.
Lejos de ser no reactivo, y en una reacción diferente a la de los aldehídos, ese carbono se puede desprotonar para convertirlo en nucleofílico:
La inversión de polaridad entre R'(H)C δ+ =O δ− y R'CLi(SR) 2 se denomina umpolung . La reacción se realiza comúnmente utilizando el 1,3-ditiano . El intermedio litiado se puede usar para varias reacciones de formación de enlaces nucleofílicos, y luego el ditiocetal se hidroliza de nuevo a su forma carbonilo. Este proceso general, la reacción de Corey-Seebach , da el equivalente sintético de un anión acilo.