transición de fase
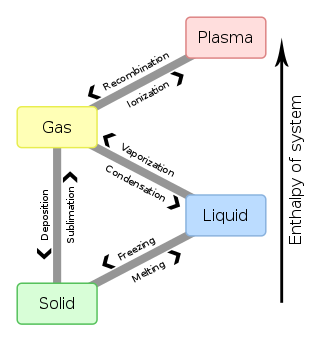
En química , termodinámica y muchos otros campos relacionados, las transiciones de fase (o cambios de fase ) son los procesos físicos de transición entre un estado de un medio, identificado por algunos parámetros, y otro, con diferentes valores de los parámetros. Comúnmente, el término se usa para referirse a cambios entre los estados básicos de la materia : sólido , líquido y gas , así como plasma en casos raros.
Por ejemplo, una fase de un sistema termodinámico y los estados de la materia tienen propiedades físicas uniformes . Durante una transición de fase de un medio dado, ciertas propiedades del medio cambian, a menudo de forma discontinua, como resultado del cambio de las condiciones externas, como la temperatura , la presión , u otras. Por ejemplo, un líquido puede convertirse en gas al calentarse hasta el punto de ebullición , lo que resulta en un cambio abrupto de volumen. La medida de las condiciones externas en las que se produce la transformación se denomina transición de fase. Las transiciones de fase ocurren comúnmente en la naturaleza y se utilizan hoy en día en muchas tecnologías.
Las transiciones de fase ocurren cuando la energía libre termodinámica de un sistema no es analítica para alguna elección de variables termodinámicas (cf. fases ). Esta condición generalmente se deriva de las interacciones de un gran número de partículas en un sistema y no aparece en sistemas que son demasiado pequeños. Es importante tener en cuenta que las transiciones de fase pueden ocurrir y están definidas para sistemas no termodinámicos, donde la temperatura no es un parámetro. Los ejemplos incluyen: transiciones de fase cuánticas, transiciones de fase dinámicas y transiciones de fase topológicas (estructurales). En este tipo de sistemas, otros parámetros toman el lugar de la temperatura. Por ejemplo, la probabilidad de conexión reemplaza la temperatura para las redes de filtración.
En el punto de transición de fase (por ejemplo, el punto de ebullición ), las dos fases de una sustancia, líquido y vapor , tienen energías libres idénticas y, por lo tanto, es igualmente probable que existan. Por debajo del punto de ebullición, el líquido es el estado más estable de los dos, mientras que por encima se prefiere la forma gaseosa.
A veces es posible cambiar el estado de un sistema diabáticamente (en oposición a adiabáticamente ) de tal manera que pueda pasar un punto de transición de fase sin sufrir una transición de fase. El estado resultante es metaestable , es decir, menos estable que la fase a la que se habría producido la transición, pero tampoco inestable. Esto ocurre en sobrecalentamiento , sobreenfriamiento y sobresaturación , por ejemplo.
Paul Ehrenfest clasificó las transiciones de fase basándose en el comportamiento de la energía libre termodinámica en función de otras variables termodinámicas. [2] Bajo este esquema, las transiciones de fase fueron etiquetadas por la derivada más baja de la energía libre que es discontinua en la transición. Las transiciones de fase de primer orden exhiben una discontinuidad en la primera derivada de la energía libre con respecto a alguna variable termodinámica. [3] Las diversas transiciones sólido/líquido/gas se clasifican como transiciones de primer orden porque implican un cambio discontinuo en la densidad, que es la (inversa de) la primera derivada de la energía libre con respecto a la presión. Transiciones de fase de segundo ordenson continuos en la primera derivada (el parámetro de orden , que es la primera derivada de la energía libre con respecto al campo externo, es continuo a través de la transición) pero exhiben discontinuidad en una segunda derivada de la energía libre. [3] Estos incluyen la transición de fase ferromagnética en materiales como el hierro, donde la magnetización , que es la primera derivada de la energía libre con respecto a la intensidad del campo magnético aplicado, aumenta continuamente desde cero a medida que la temperatura desciende por debajo de la temperatura de Curie . . La susceptibilidad magnética, la segunda derivada de la energía libre con el campo, cambia discontinuamente. Según el esquema de clasificación de Ehrenfest, en principio podría haber transiciones de fase de tercer, cuarto y orden superior.