hipoclorito
En química , el hipoclorito es un anión con la fórmula química ClO- . Se combina con varios cationes para formar sales de hipoclorito. Los ejemplos comunes incluyen hipoclorito de sodio ( lejía doméstica ) e hipoclorito de calcio (un componente del polvo blanqueador, "cloro" de piscina). [1] La distancia Cl-O en ClO − es 1,69 Å. [2]
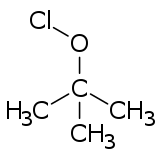
El nombre también puede referirse a ésteres de ácido hipocloroso, es decir, compuestos orgánicos con un grupo ClO– unido covalentemente al resto de la molécula. El ejemplo principal es el hipoclorito de terc-butilo , que es un agente de cloración útil. [3]
La mayoría de las sales de hipoclorito se manejan como soluciones acuosas . Sus principales aplicaciones son como agentes de blanqueo, desinfección y tratamiento de agua . También se utilizan en química para reacciones de cloración y oxidación .
La acidificación de los hipocloritos genera ácido hipocloroso , que existe en equilibrio con el cloro. Un pH alto impulsa la reacción hacia la izquierda:
Los hipocloritos son generalmente inestables y muchos compuestos existen solo en solución. El hipoclorito de litio LiOCl, el hipoclorito de calcio Ca(OCl) 2 y el hipoclorito de bario Ba(ClO) 2 se han aislado como compuestos anhidros puros . Todos son sólidos. Se pueden producir algunos más como soluciones acuosas . En general cuanto mayor es la dilución mayor es su estabilidad. No es posible determinar tendencias para las sales de metales alcalinotérreos, ya que muchas de ellas no se pueden formar. El hipoclorito de berilio es inaudito. No se puede preparar hipoclorito de magnesio puro; sin embargo, se conoce Mg(OH)OCl sólido. [4] El hipoclorito de calcio se produce a escala industrial y tiene buena estabilidad. El hipoclorito de estroncio, Sr(OCl) 2 , no está bien caracterizado y aún no se ha determinado su estabilidad. [5]
Esta reacción es exotérmica y, en el caso de hipocloritos concentrados, como LiOCl y Ca(OCl) 2 , puede provocar una fuga térmica peligrosa y posibles explosiones. [6] [7]