Ritmo circadiano
| Ritmo circadiano | |
|---|---|
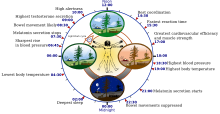 Características del reloj biológico circadiano humano | |
| Pronunciación | |
| Frecuencia | Se repite aproximadamente cada 24 horas. |
Un ritmo circadiano ( / s ər k eɪ d i ə n / ), o ciclo circadiano , es un proceso natural, interna que regula el ciclo de sueño-vigilia y se repite aproximadamente cada 24 horas. [1] Puede referirse a cualquier proceso que se origina dentro de un organismo (es endógeno ) y responde al ambiente ( arrastrado por el ambiente). Estos ritmos de 24 horas son impulsados por un reloj circadiano y se han observado ampliamente en plantas , animales , hongos y cianobacterias.. [2]
El término circadiano proviene del latín circa , que significa "alrededor" (o "aproximadamente") y diēm , que significa "día". Los procesos con ciclos de 24 horas se denominan más generalmente ritmos diurnos ; Los ritmos diurnos no deben denominarse ritmos circadianos a menos que puedan confirmarse como endógenos y no ambientales. [3]
Aunque los ritmos circadianos son endógenos, se ajustan al entorno local mediante señales externas llamadas zeitgebers (en alemán, "dadores de tiempo"), que incluyen ciclos de luz, temperatura y redox . En entornos clínicos, un ritmo circadiano anormal en los seres humanos se conoce como trastorno del ritmo circadiano del sueño . [4]
Historia
Si bien hay múltiples menciones de "ciclo natural del cuerpo" en las culturas orientales y nativos americanos, las cuentas occidentales registrados más tempranos de una fecha de proceso circadiano desde el siglo cuarto antes de Cristo, cuando Androsthenes , un capitán del buque sirviendo bajo Alejandro Magno , describe diurnas movimientos foliares del árbol de tamarindo . [5] La observación de un proceso circadiano o diurno en humanos se menciona en textos médicos chinos que datan de alrededor del siglo XIII, incluido el Manual del mediodía y la medianoche y elRima mnemotécnica para ayudar en la selección de los puntos de acupuntura según el ciclo diurno, el día del mes y la estación del año . [6]
En 1729, el científico francés Jean-Jacques d'Ortous de Mairan realizó el primer experimento diseñado para distinguir un reloj endógeno de las respuestas a los estímulos diarios. Señaló que los patrones de 24 horas en el movimiento de las hojas de la planta Mimosa pudica persistían incluso cuando las plantas se mantenían en constante oscuridad. [7] [8]
En 1896, Patrick y Gilbert observaron que durante un período prolongado de privación del sueño, la somnolencia aumenta y disminuye con un período de aproximadamente 24 horas. [9] En 1918, JS Szymanski demostró que los animales son capaces de mantener patrones de actividad de 24 horas en ausencia de señales externas como la luz y los cambios de temperatura. [10]
A principios del siglo XX, los ritmos circadianos se notaron en los tiempos de alimentación rítmica de las abejas. Auguste Forel , Ingeborg Beling y Oskar Wahl realizaron numerosos experimentos para determinar si este ritmo era atribuible a un reloj endógeno. [11] La existencia del ritmo circadiano fue descubierta de forma independiente en la mosca de la fruta en 1935 por dos zoólogos alemanes, Hans Kalmus y Erwin Bünning . [12] [13]
En 1954, un importante experimento informado por Colin Pittendrigh demostró que la eclosión (el proceso de crisálida que se convierte en adulta) en Drosophila pseudoobscura era un comportamiento circadiano. Demostró que si bien la temperatura juega un papel vital en el ritmo de la eclosión, el período de eclosión se retrasa pero no se detiene cuando la temperatura baja. [14] [13]
El término circadiano fue acuñado por Franz Halberg en 1959. [15] Según la definición original de Halberg:
El término "circadiano" se deriva de circa (aproximadamente) y muere (día); puede servir para dar a entender que ciertos períodos fisiológicos se acercan a las 24 horas, si no exactamente esa duración. En este documento, "circadiano" podría aplicarse a todos los ritmos de "24 horas", independientemente de que sus períodos, individualmente o en promedio, sean diferentes de 24 horas, más largos o más cortos, en unos pocos minutos u horas. [16] [17]
En 1977, el Comité Internacional de Nomenclatura de la Sociedad Internacional de Cronobiología adoptó formalmente la definición:
Circadiano: relativo a variaciones biológicas o ritmos con una frecuencia de 1 ciclo en 24 ± 4 h; circa (aproximadamente, aproximadamente) y muere (día o 24 h). Nota: el término describe ritmos con una duración de ciclo de aproximadamente 24 h, ya sea que estén sincronizados en frecuencia con (aceptable) o desincronizados o de ejecución libre de la escala de tiempo ambiental local, con periodos ligeramente pero consistentemente diferentes de 24 h. [18]
Ron Konopka y Seymour Benzer identificaron la primera mutación del reloj en Drosophila en 1971, nombrando al gen " período " ( per ) gen, el primer determinante genético descubierto de la ritmicidad conductual. [19] por gen fue aislado en 1984 por dos equipos de investigadores. Konopka, Jeffrey Hall, Michael Roshbash y su equipo demostraron que el per locus es el centro del ritmo circadiano y que la pérdida de per detiene la actividad circadiana. [20] [21] Al mismo tiempo, el equipo de Michael W. Young informó efectos similares de por, y que el gen cubre un intervalo de 7.1 kilobase (kb) en el cromosoma X y codifica un poli (A) + ARN de 4.5 kb. [22] [23] Continuaron descubriendo los genes y neuronas clave en el sistema circadiano de Drosophila , por lo que Hall, Rosbash y Young recibieron el Premio Nobel de Fisiología o Medicina 2017 . [24]
Joseph Takahashi descubrió la primera mutación del reloj circadiano en mamíferos ( clockΔ19 ) usando ratones en 1994. [25] [26] Sin embargo, estudios recientes muestran que la eliminación del reloj no conduce a un fenotipo conductual (los animales todavía tienen ritmos circadianos normales), que cuestiona su importancia en la generación de ritmos. [27] [28]
La primera mutación del reloj humano fue identificada en una familia extendida de Utah por Chris Jones, y caracterizada genéticamente por Ying-Hui Fu y Louis Ptacek. Los individuos afectados son "alondras matutinas" extremas con 4 horas de sueño avanzado y otros ritmos. Esta forma de fase de sueño avanzada familiar es causada por un único cambio de aminoácido, S662➔G, en la proteína PER2 humana. [29] [30]
Criterios
Para ser llamado circadiano, un ritmo biológico debe cumplir estos tres criterios generales: [31]
- El ritmo tiene un período endógeno de ejecución libre que dura aproximadamente 24 horas. El ritmo persiste en condiciones constantes (es decir, oscuridad constante) con un período de aproximadamente 24 horas. El período del ritmo en condiciones constantes se denomina período de ejecución libre y se denota con la letra griega τ (tau). El fundamento de este criterio es distinguir los ritmos circadianos de las respuestas simples a las señales externas diarias. No se puede decir que un ritmo sea endógeno a menos que haya sido probado y persista en condiciones sin entrada periódica externa. En animales diurnos (activos durante el día), en general τ es ligeramente superior a 24 horas, mientras que, en animales nocturnos (activos durante la noche), en general τ es inferior a 24 horas.
- Los ritmos son entrenables. El ritmo se puede restablecer mediante la exposición a estímulos externos (como la luz y el calor), un proceso llamado arrastre . El estímulo externo utilizado para introducir un ritmo se llama Zeitgeber o "dador de tiempo". Viajar a través de zonas horarias ilustra la capacidad del reloj biológico humano para adaptarse a la hora local; una persona suele experimentar desfase horario antes de que la sincronización de su reloj circadiano lo haya sincronizado con la hora local.
- Los ritmos exhiben compensación de temperatura. En otras palabras, mantienen la periodicidad circadiana en un rango de temperaturas fisiológicas. Muchos organismos viven en una amplia gama de temperaturas y las diferencias en la energía térmica afectarán la cinética de todos los procesos moleculares en sus células. Para realizar un seguimiento del tiempo, el reloj circadiano del organismo debe mantener una periodicidad de aproximadamente 24 horas a pesar de la cinética cambiante, una propiedad conocida como compensación de temperatura. El coeficiente de temperatura Q 10 es una medida de este efecto compensador. Si el coeficiente Q 10 permanece aproximadamente a 1 a medida que aumenta la temperatura, se considera que el ritmo está compensado por la temperatura.
Origen
En esta sección falta información sobre la evolución independiente cuatro veces [PMID 11533719]. ( Septiembre de 2021 ) |
Los ritmos circadianos permiten a los organismos anticiparse y prepararse para cambios ambientales precisos y regulares. Por lo tanto, permiten a los organismos capitalizar mejor los recursos ambientales (por ejemplo, luz y alimentos) en comparación con aquellos que no pueden predecir dicha disponibilidad. Por tanto, se ha sugerido que los ritmos circadianos ponen a los organismos en una ventaja selectiva en términos evolutivos. Sin embargo, la ritmicidad parece ser tan importante en la regulación y coordinación de los procesos metabólicos internos como en la coordinación con el entorno . [32] Esto se sugiere por el mantenimiento (heredabilidad) de los ritmos circadianos en las moscas de la fruta después de varios cientos de generaciones en condiciones constantes de laboratorio, [33]así como en criaturas en constante oscuridad en la naturaleza, y por la eliminación experimental de los ritmos circadianos conductuales, pero no fisiológicos, en las codornices . [34] [35]
Lo que impulsó la evolución de los ritmos circadianos ha sido una cuestión enigmática. Las hipótesis anteriores enfatizaron que las proteínas fotosensibles y los ritmos circadianos pueden haberse originado juntos en las células más tempranas, con el propósito de proteger el ADN en replicación de los altos niveles de radiación ultravioleta dañina durante el día. Como resultado, la replicación quedó relegada a la oscuridad. Sin embargo, faltan pruebas de esto, ya que los organismos más simples con un ritmo circadiano, las cianobacterias, hacen lo contrario de esto: se dividen más durante el día. [36] En cambio, estudios recientes destacan la importancia de la coevolución de proteínas redox con osciladores circadianos en los tres dominios de la vida después del Gran Evento de Oxidación hace aproximadamente 2.300 millones de años.[2] [4] La opinión actual es que los cambios circadianos en los niveles de oxígeno ambiental y la producción de especies reactivas de oxígeno (ROS) en presencia de la luz del día probablemente hayan impulsado la necesidad de desarrollar ritmos circadianos para adelantarse y, por lo tanto, contrarrestar, reacciones redox dañinas a diario.
Los relojes circadianos más simples conocidos son los ritmos circadianos bacterianos , ejemplificados por las cianobacterias procariotas . Investigaciones recientes han demostrado que el reloj circadiano de Synechococcus elongatus puede reconstituirse in vitro con sólo las tres proteínas ( KaiA , KaiB , KaiC ) [37] de su oscilador central. Se ha demostrado que este reloj mantiene un ritmo de 22 horas durante varios días tras la adición de ATP . Las explicaciones anteriores del cronometrador circadiano procariótico dependían de un mecanismo de retroalimentación de transcripción / traducción del ADN. [cita requerida ]
Se identificó un defecto en el homólogo humano del gen del " período " de Drosophila como causa del trastorno del sueño FASPS (síndrome familiar de fase avanzada del sueño ), lo que subraya la naturaleza conservada del reloj circadiano molecular a lo largo de la evolución. Ahora se conocen muchos más componentes genéticos del reloj biológico. Sus interacciones dan como resultado un ciclo de retroalimentación entrelazado de productos genéticos que resulta en fluctuaciones periódicas que las células del cuerpo interpretan como una hora específica del día. [38]
Ahora se sabe que el reloj circadiano molecular puede funcionar dentro de una sola célula; es decir, es autónomo de células. [39] Esto fue demostrado por Gene Block en neuronas retinianas basales aisladas de moluscos (BRN). [40] Al mismo tiempo, diferentes células pueden comunicarse entre sí dando como resultado una salida sincronizada de señalización eléctrica. Estos pueden interactuar con las glándulas endocrinas del cerebro para producir la liberación periódica de hormonas. Los receptores de estas hormonas pueden estar ubicados a lo largo del cuerpo y sincronizar los relojes periféricos de varios órganos. Por lo tanto, la información de la hora del día transmitida por los ojosviaja al reloj en el cerebro y, a través de él, los relojes en el resto del cuerpo pueden sincronizarse. Así es como el reloj biológico controla coordinadamente el tiempo de sueño / vigilia, temperatura corporal, sed y apetito, por ejemplo. [41] [42]
Importancia en los animales
El ritmo circadiano está presente en los patrones de sueño y alimentación de los animales, incluidos los seres humanos. También hay patrones claros de temperatura corporal central, actividad de ondas cerebrales , producción de hormonas , regeneración celular y otras actividades biológicas. Además, fotoperiodismo, la reacción fisiológica de los organismos a la duración del día o de la noche, es vital tanto para las plantas como para los animales, y el sistema circadiano juega un papel en la medición e interpretación de la duración del día. La predicción oportuna de los períodos estacionales de las condiciones climáticas, la disponibilidad de alimentos o la actividad de los depredadores es crucial para la supervivencia de muchas especies. Aunque no es el único parámetro, la duración cambiante del fotoperíodo ('duración del día') es la señal ambiental más predictiva para el tiempo estacional de la fisiología y el comportamiento, más notablemente para el tiempo de migración, hibernación y reproducción. [43]
Efecto de la alteración circadiana
Las mutaciones o deleciones del gen del reloj en ratones han demostrado la importancia de los relojes corporales para asegurar el momento adecuado de los eventos celulares / metabólicos; Los ratones con mutación del reloj son hiperfágicos y obesos, y tienen alteraciones del metabolismo de la glucosa. [44] En ratones, la deleción del gen del reloj alfa Rev-ErbA facilita la obesidad inducida por la dieta y cambia el equilibrio entre la utilización de glucosa y lípidos que predisponen a la diabetes. [45] Sin embargo, no está claro si existe una fuerte asociación entre los polimorfismos del gen del reloj en los seres humanos y la susceptibilidad a desarrollar el síndrome metabólico. [46] [47]
Efecto del ciclo de luz-oscuridad
El ritmo está vinculado al ciclo claro-oscuro. Los animales, incluidos los humanos, que se mantienen en total oscuridad durante períodos prolongados, finalmente funcionan con un ritmo libre . Su ciclo de sueño se retrasa o avanza cada "día", dependiendo de si su "día", su período endógeno , es más corto o más largo que 24 horas. Las señales ambientales que restablecen los ritmos cada día se denominan zeitgebers (del alemán, "dadores de tiempo"). [48] Los mamíferos subterráneos totalmente ciegos, por ejemplo, la rata topo ciega Spalax sp., Son capaces de mantener sus relojes endógenos en la aparente ausencia de estímulos externos. Aunque carecen de ojos formadores de imágenes, sus fotorreceptores (que detectan la luz) siguen funcionando;también salen a la superficie periódicamente.[ página necesaria ] [49]
Los organismos que corren libremente que normalmente tienen uno o dos episodios de sueño consolidados aún los tendrán cuando se encuentren en un ambiente protegido de señales externas, pero el ritmo no está ligado al ciclo de luz-oscuridad de 24 horas en la naturaleza. En estas circunstancias, el ritmo sueño-vigilia puede desfasarse con otros ritmos circadianos o ultradianos , como los ritmos metabólicos, hormonales, eléctricos del SNC o neurotransmisores. [50]
Investigaciones recientes han influido en el diseño de entornos de naves espaciales , ya que se ha descubierto que los sistemas que imitan el ciclo de luz y oscuridad son muy beneficiosos para los astronautas. [ fuente médica no confiable? ] [51] Se ha probado la fototerapia como tratamiento para los trastornos del sueño .
Animales árticos
Investigadores noruegos de la Universidad de Tromsø han demostrado que algunos animales árticos ( perdiz blanca , reno ) muestran ritmos circadianos solo en las partes del año que tienen amaneceres y atardeceres diarios. En un estudio de renos, los animales a 70 grados norte mostraron ritmos circadianos en otoño, invierno y primavera, pero no en verano. Los renos en Svalbard a 78 grados norte mostraron tales ritmos solo en otoño y primavera. Los investigadores sospechan que otros animales árticos también pueden no mostrar ritmos circadianos a la luz constante del verano y la oscuridad constante del invierno. [52]
Un estudio de 2006 en el norte de Alaska encontró que las ardillas terrestres diurnas y los puercoespines nocturnos mantienen estrictamente sus ritmos circadianos durante 82 días y noches de sol. Los investigadores especulan que estos dos roedores notan que la distancia aparente entre el sol y el horizonte es más corta una vez al día y, por lo tanto, tienen una señal suficiente para arrastrarse (ajustarse). [53]
Mariposa y polilla
La navegación de la migración otoñal de la mariposa monarca del este de América del Norte ( Danaus plexippus ) a sus zonas de hibernación en el centro de México utiliza una brújula solar con compensación de tiempo que depende de un reloj circadiano en sus antenas. [54] [55] También se sabe que el ritmo circadiano controla el comportamiento de apareamiento en ciertas especies de polillas como Spodoptera littoralis , donde las hembras producen feromonas específicas que atraen y restablecen el ritmo circadiano masculino para inducir el apareamiento durante la noche. [56]
En plantas
Los ritmos circadianos de la planta le dicen a la planta en qué estación es y cuándo florecer para tener la mejor oportunidad de atraer polinizadores. Los comportamientos que muestran ritmos incluyen el movimiento de las hojas, el crecimiento, la germinación, el intercambio estomático / gaseoso, la actividad enzimática, la actividad fotosintética y la emisión de fragancias, entre otros. [57]Los ritmos circadianos ocurren cuando una planta se sincroniza con el ciclo de luz de su entorno circundante. Estos ritmos se generan de forma endógena, se mantienen por sí mismos y son relativamente constantes en un rango de temperaturas ambientales. Las características importantes incluyen dos bucles de retroalimentación de transcripción-traducción que interactúan: proteínas que contienen dominios PAS, que facilitan las interacciones proteína-proteína; y varios fotorreceptores que ajustan el reloj a diferentes condiciones de luz. La anticipación de cambios en el ambiente permite cambios apropiados en el estado fisiológico de una planta, lo que le confiere una ventaja adaptativa. [58]Una mejor comprensión de los ritmos circadianos de las plantas tiene aplicaciones en la agricultura, como ayudar a los agricultores a escalonar las cosechas para extender la disponibilidad de los cultivos y protegerse contra pérdidas masivas debido al clima.
La luz es la señal mediante la cual las plantas sincronizan sus relojes internos con su entorno y es detectada por una amplia variedad de fotorreceptores. La luz roja y azul se absorbe a través de varios fitocromos y criptocromos . Un fitocromo, phyA, es el principal fitocromo en las plántulas que crecen en la oscuridad, pero se degrada rápidamente con la luz para producir Cry1. Los fitocromos B – E son más estables con phyB, el principal fitocromo en las plántulas que crecen a la luz. El gen del criptocromo (cry) también es un componente sensible a la luz del reloj circadiano y se cree que participa como fotorreceptor y como parte del mecanismo de marcapasos endógeno del reloj. Los criptocromos 1-2 (involucrados en azul-UVA) ayudan a mantener la duración del período en el reloj a través de una amplia gama de condiciones de luz. [57] [58]
El oscilador central genera un ritmo autosostenido y es impulsado por dos bucles de retroalimentación interactivos que están activos en diferentes momentos del día. El ciclo matutino consta de CCA1 (circadiano y asociado al reloj 1) y LHY (hipocótilo alargado tardío), que codifican factores de transcripción MYB estrechamente relacionados que regulan los ritmos circadianos en Arabidopsis , así como PRR 7 y 9 (reguladores de pseudorespuesta). El ciclo vespertino consta de GI (Gigantea) y ELF4, ambos involucrados en la regulación de los genes del tiempo de floración. [59] [60] Cuando CCA1 y LHY se sobreexpresan (en condiciones constantes de luz u oscuridad), las plantas se vuelven arrítmicas y las señales de ARNm se reducen, lo que contribuye a un ciclo de retroalimentación negativa. La expresión génica de CCA1 y LHY oscila y alcanza su punto máximo temprano en la mañana, mientras queLa expresión del gen TOC1 oscila y alcanza su punto máximo en las primeras horas de la noche. Si bien anteriormente se planteó la hipótesis de que estos tres genes modelan un ciclo de retroalimentación negativa en el que CCA1 y LHY sobreexpresados reprimen TOC1 y TOC1 sobreexpresado es un regulador positivo de CCA1 y LHY, [58] lo demostró en 2012 Andrew Millar y otros que TOC1, de hecho, sirve como represor no solo de CCA1, LHY y PRR7 y 9 en el ciclo de la mañana, sino también de GI y ELF4 en el ciclo de la noche. Este hallazgo y el modelado computacional adicional de las funciones e interacciones del gen TOC1 sugieren un reencuadre del reloj circadiano de la planta como un modelo represor de triple componente negativo en lugar del ciclo de retroalimentación de elementos positivos / negativos que caracteriza el reloj en los mamíferos.[61]
En 2018, los investigadores encontraron que la expresión de las transcripciones nacientes de PRR5 y TOC1 hnRNA sigue el mismo patrón oscilatorio que las transcripciones de ARNm procesadas rítmicamente en A. thaliana.LNKs se une a la región 5 'de PRR5 y TOC1 e interactúa con RNAP II y otros factores de transcripción . Además, la interacción RVE8-LNKs permite modificar un patrón permisivo de metilación de histonas (H3K4me3) y la modificación de histonas en sí es paralela a la oscilación de la expresión del gen del reloj. [62]
Se ha descubierto anteriormente que hacer coincidir el ritmo circadiano de una planta con los ciclos de luz y oscuridad de su entorno externo tiene el potencial de afectar positivamente a la planta. [63] Los investigadores llegaron a esta conclusión realizando experimentos en tres variedades diferentes de Arabidopsis thaliana . Una de estas variedades tenía un ciclo circadiano normal de 24 horas. [63] Las otras dos variedades fueron mutadas, una para tener un ciclo circadiano de más de 27 horas y la otra para tener un ciclo circadiano más corto de lo normal de 20 horas. [63]
La Arabidopsis con el ciclo circadiano de 24 horas se cultivó en tres entornos diferentes. [63] Uno de estos entornos tenía un ciclo de luz y oscuridad de 20 horas (10 horas de luz y 10 horas de oscuridad), el otro tenía un ciclo de luz y oscuridad de 24 horas (12 horas de luz y 12 horas de oscuridad) , y el ambiente final tuvo un ciclo de luz y oscuridad de 28 horas (14 horas de luz y 14 horas de oscuridad). [63] Las dos plantas mutadas se cultivaron tanto en un entorno que tenía un ciclo de luz y oscuridad de 20 horas como en un entorno que tenía un ciclo de luz y oscuridad de 28 horas. [63] Se descubrió que la variedad de Arabidopsis con un ciclo de ritmo circadiano de 24 horas crecía mejor en un entorno que también tenía un ciclo de luz y oscuridad de 24 horas.[63] En general, se encontró que todas las variedades de Arabidopsis thaliana tenían mayores niveles de clorofila y un mayor crecimiento en entornos cuyos ciclos de luz y oscuridad coincidían con su ritmo circadiano. [63]
Los investigadores sugirieron que una razón de esto podría ser que hacer coincidir el ritmo circadiano de una Arabidopsis con su entorno podría permitir que la planta esté mejor preparada para el amanecer y el anochecer, y así poder sincronizar mejor sus procesos. [63] En este estudio, también se encontró que los genes que ayudan a controlar la clorofila alcanzaron su punto máximo unas pocas horas después del amanecer. [63] Esto parece ser coherente con el fenómeno propuesto conocido como amanecer metabólico. [64]
Según la hipótesis del amanecer metabólico, los azúcares producidos por la fotosíntesis tienen el potencial de ayudar a regular el ritmo circadiano y ciertas vías fotosintéticas y metabólicas. [64] [65] A medida que sale el sol, hay más luz disponible, lo que normalmente permite que ocurra más fotosíntesis. [64] Los azúcares producidos por la fotosíntesis reprimen PRR7. [66] Esta represión de PRR7 conduce a un aumento de la expresión de CCA1. [66] Por otro lado, la disminución de los niveles de azúcar fotosintético aumenta la expresión de PRR7 y disminuye la expresión de CCA1. [64] Este circuito de retroalimentación entre CCA1 y PRR7 es lo que se propone para causar un amanecer metabólico. [64] [67]
En Drosophila
El mecanismo molecular del ritmo circadiano y la percepción de la luz se comprenden mejor en Drosophila . Los genes reloj se descubren en Drosophila y actúan junto con las neuronas reloj. Hay dos ritmos únicos, uno durante el proceso de eclosión (llamado eclosión ) de la pupa y el otro durante el apareamiento. [68] Las neuronas del reloj están ubicadas en grupos distintos en el cerebro central. Las neuronas reloj mejor entendidas son las neuronas ventrales laterales grandes y pequeñas (l-LNvs y s-LNvs) del lóbulo óptico . Estas neuronas producen el factor de dispersión de pigmentos (PDF), un neuropéptido que actúa como neuromodulador circadiano entre diferentes neuronas de reloj. [69]
El ritmo circadiano de Drosophila se realiza a través de un bucle de retroalimentación de transcripción-traducción. El mecanismo del reloj central consta de dos bucles de retroalimentación interdependientes, a saber, el bucle PER / TIM y el bucle CLK / CYC. [70] El bucle CLK / CYC se produce durante el día e inicia la transcripción de los genes per y tim . Pero sus niveles de proteínas permanecen bajos hasta el anochecer, porque durante el día también se activa el gen del doble tiempo ( dbt ). La proteína DBT provoca la fosforilación y el recambio de las proteínas PER monoméricas. [71] [72]TIM también es fosforilado por Shaggy hasta la puesta del sol. Después de la puesta del sol, DBT desaparece, por lo que las moléculas PER se unen de manera estable a TIM. El dímero PER / TIM ingresa al núcleo varias veces por la noche y se une a los dímeros CLK / CYC. El PER unido detiene completamente la actividad transcripcional de CLK y CYC. [73]
Temprano en la mañana, la luz activa el gen cry y su proteína CRY provoca la descomposición de TIM. Por tanto, el dímero PER / TIM se disocia y el PER libre se vuelve inestable. PER sufre una fosforilación progresiva y, en última instancia, una degradación. La ausencia de PER y TIM permite la activación de los genes clk y cyc . Por lo tanto, el reloj se reinicia para iniciar el siguiente ciclo circadiano. [74]
Modelo PER-TIM
Este modelo de proteína se desarrolló basándose en las oscilaciones de las proteínas PER y TIM en Drosophila . [75] Se basa en su predecesor, el modelo PER, donde se explicó cómo el gen per y su proteína influyen en el reloj biológico. [76] El modelo incluye la formación de un complejo PER-TIM nuclear que influye en la transcripción de los genes per y tim (proporcionando retroalimentación negativa) y la fosforilación múltiple de estas dos proteínas. Las oscilaciones circadianas de estas dos proteínas parecen sincronizarse con el ciclo de luz-oscuridad incluso si no son necesariamente dependientes de él. [77] [75]Tanto las proteínas PER como las TIM se fosforilan y, después de formar el complejo nuclear PER-TIM, regresan al interior del núcleo para detener la expresión del ARNm per y tim. Esta inhibición dura mientras la proteína o el ARNm no se degraden. [75] Cuando esto sucede, el complejo libera la inhibición. Aquí también se puede mencionar que la degradación de la proteína TIM se acelera con la luz. [77]
En mamíferos
El reloj circadiano primario en los mamíferos se encuentra en el núcleo supraquiasmático (o núcleos) (SCN), un par de grupos distintos de células ubicadas en el hipotálamo . La destrucción del SCN da como resultado la ausencia total de un ritmo regular de sueño-vigilia. El SCN recibe información sobre la iluminación a través de los ojos. La retina del ojo contiene fotorreceptores "clásicos" (" bastones " y " conos "), que se utilizan para la visión convencional. Pero la retina también contiene células ganglionares especializadas.que son directamente fotosensibles y se proyectan directamente al SCN, donde ayudan en el arrastre (sincronización) de este reloj circadiano maestro. Las proteínas involucradas en el reloj SCN son homólogas a las que se encuentran en la mosca de la fruta. [78]
Estas células contienen el fotopigmento melanopsina y sus señales siguen una vía llamada tracto retinohipotalámico , que conduce al SCN. Si las células del SCN se extraen y cultivan, mantienen su propio ritmo en ausencia de señales externas. [79]
El SCN toma la información sobre la duración del día y la noche de la retina, la interpreta y la transmite a la glándula pineal , una estructura diminuta con forma de piña y ubicada en el epitálamo . En respuesta, la pineal secreta la hormona melatonina . [80] La secreción de melatonina alcanza su punto máximo durante la noche y disminuye durante el día y su presencia proporciona información sobre la duración de la noche.
Varios estudios han indicado que la melatonina pineal se retroalimenta en la ritmicidad del SCN para modular los patrones circadianos de actividad y otros procesos. Sin embargo, se desconoce la naturaleza y la importancia a nivel de sistema de esta retroalimentación. [81]
Los ritmos circadianos de los seres humanos se pueden arrastrar a períodos ligeramente más cortos y más largos que las 24 horas de la Tierra. Investigadores de Harvard han demostrado que los sujetos humanos pueden al menos ser incorporados a un ciclo de 23,5 horas y a un ciclo de 24,65 horas (este último es el ciclo natural día-noche solar en el planeta Marte ). [82]
Humanos
Las primeras investigaciones sobre los ritmos circadianos sugirieron que la mayoría de las personas preferían un día más cercano a las 25 horas cuando estaban aisladas de los estímulos externos como la luz del día y la hora normal. Sin embargo, esta investigación fue defectuosa porque no protegió a los participantes de la luz artificial. Aunque los sujetos estaban protegidos de las señales de tiempo (como los relojes) y la luz del día, los investigadores no eran conscientes de los efectos de retraso de fase de las luces eléctricas interiores. [83] [ dudoso ] A los sujetos se les permitió encender la luz cuando estaban despiertos y apagarla cuando querían dormir. La luz eléctrica de la tarde retrasó su fase circadiana. [84] Un estudio más riguroso realizado en 1999 por la Universidad de Harvard.estimó que el ritmo humano natural está más cerca de las 24 horas y 11 minutos: mucho más cercano al día solar . [85] De acuerdo con esta investigación, hubo un estudio más reciente de 2010 que también identificó diferencias de sexo con el período circadiano para las mujeres siendo ligeramente más corto (24.09 horas) que para los hombres (24.19 horas). [86] En este estudio, las mujeres tendían a despertarse antes que los hombres y exhibían una mayor preferencia por las actividades matutinas que los hombres, aunque se desconocen los mecanismos biológicos subyacentes de estas diferencias. [86]
Marcadores y efectos biológicos
Los marcadores de fase clásicos para medir la sincronización del ritmo circadiano de un mamífero son:
- secreción de melatonina por la glándula pineal , [87]
- temperatura corporal central mínima, [87] y
- nivel plasmático de cortisol . [88]
Para los estudios de temperatura, los sujetos deben permanecer despiertos pero tranquilos y semi-reclinados casi en la oscuridad mientras se toman continuamente la temperatura rectal. Aunque la variación es grande entre los cronotipos normales , la temperatura promedio de un adulto humano alcanza su mínimo alrededor de las 5:00 am, aproximadamente dos horas antes de la hora habitual de despertar. Baehr y col. [89] encontró que, en los adultos jóvenes, la temperatura corporal diaria mínima ocurrió alrededor de las 04:00 (4 am) para los tipos matutinos, pero alrededor de las 06:00 (6 am) para los tipos nocturnos. Este mínimo ocurrió aproximadamente a la mitad del período de sueño de ocho horas para los tipos de la mañana, pero más cerca del despertar en los tipos de noche.
La melatonina está ausente del sistema o es indetectablemente baja durante el día. Su inicio en luz tenue, inicio de melatonina en luz tenue (DLMO), aproximadamente a las 21:00 (9 pm) se puede medir en la sangre o la saliva. Su principal metabolito también se puede medir en la orina de la mañana. Tanto la DLMO como el punto medio (en el tiempo) de la presencia de la hormona en la sangre o la saliva se han utilizado como marcadores circadianos. Sin embargo, investigaciones más recientes indican que la compensación de melatonina puede ser el marcador más confiable. Benloucif y col. [87]encontraron que los marcadores de fase de melatonina eran más estables y estaban más altamente correlacionados con el momento del sueño que la temperatura central mínima. Descubrieron que tanto la compensación del sueño como la compensación de la melatonina están más fuertemente correlacionadas con los marcadores de fase que con el inicio del sueño. Además, la fase decreciente de los niveles de melatonina es más confiable y estable que la terminación de la síntesis de melatonina.
Otros cambios fisiológicos que ocurren de acuerdo con un ritmo circadiano incluyen la frecuencia cardíaca y muchos procesos celulares, incluido el estrés oxidativo , el metabolismo celular , las respuestas inmunes e inflamatorias, la modificación epigenética , las vías de respuesta de hipoxia / hiperoxia , el estrés reticular endoplásmico , la autofagia y la regulación del tallo. entorno celular ". [90] En un estudio de hombres jóvenes, se encontró que la frecuencia cardíaca alcanza su frecuencia promedio más baja durante el sueño y su frecuencia promedio más alta poco después de despertarse. [91]
En contradicción con estudios anteriores, se ha encontrado que no existe ningún efecto de la temperatura corporal sobre el rendimiento en las pruebas psicológicas. Esto probablemente se deba a las presiones evolutivas para una función cognitiva superior en comparación con las otras áreas de función examinadas en estudios anteriores. [92]
Fuera del "reloj maestro"
Los ritmos circadianos más o menos independientes se encuentran en muchos órganos y células del cuerpo fuera de los núcleos supraquiasmáticos (SCN), el "reloj maestro". De hecho, el neurocientífico Joseph Takahashi y sus colegas afirmaron en un artículo de 2013 que "casi todas las células del cuerpo contienen un reloj circadiano". [93] Por ejemplo, estos relojes, llamados osciladores periféricos, se han encontrado en la glándula suprarrenal, el esófago , los pulmones , el hígado , el páncreas , el bazo , el timo y la piel. [94] [95] [96] También hay alguna evidencia de que el bulbo olfatorio [97] y la próstata [98] puede experimentar oscilaciones, al menos cuando se cultiva.
Aunque los osciladores de la piel responden a la luz, no se ha demostrado una influencia sistémica. [99] Además, se ha demostrado que muchos osciladores, como las células del hígado, por ejemplo, responden a entradas distintas de la luz, como la alimentación. [100]
La luz y el reloj biológico
La luz reinicia el reloj biológico de acuerdo con la curva de respuesta de fase (PRC). Dependiendo del momento, la luz puede hacer avanzar o retrasar el ritmo circadiano. Tanto la RPC como la iluminancia requerida varían de una especie a otra y se requieren niveles de luz más bajos para restablecer los relojes en los roedores nocturnos que en los humanos. [101]
Ciclos más largos o más cortos obligatorios
Varios estudios en humanos han hecho uso de ciclos forzados de sueño / vigilia muy diferentes de los de 24 horas, como los realizados por Nathaniel Kleitman en 1938 (28 horas) y Derk-Jan Dijk y Charles Czeisler en la década de 1990 (20 horas). Debido a que las personas con un reloj circadiano normal (típico) no pueden sincronizar estos ritmos anormales de día / noche, [102] esto se conoce como un protocolo de desincronía forzada. Según dicho protocolo, los episodios de sueño y vigilia se desacoplan del período circadiano endógeno del cuerpo, lo que permite a los investigadores evaluar los efectos de la fase circadiana (es decir, el momento relativo del ciclo circadiano) en aspectos del sueño y la vigilia, incluida la latencia del sueño.y otras funciones, tanto fisiológicas, conductuales y cognitivas. [103] [104] [105] [106] [107]
Los estudios también muestran que Cyclosa turbinata es única en el sentido de que su actividad locomotora y de construcción de redes hace que tenga un reloj circadiano de período excepcionalmente corto, alrededor de 19 horas. Cuando las arañas C. turbinata se colocan en cámaras con períodos de 19, 24 o 29 horas de luz y oscuridad divididas uniformemente, ninguna de las arañas exhibió una menor longevidad en su propio reloj circadiano. Estos hallazgos sugieren que C. turbinata no sufre los mismos costos de desincronización extrema que otras especies de animales.
Salud humana
La sincronización del tratamiento médico en coordinación con el reloj biológico , la cronoterapia , puede aumentar significativamente la eficacia y reducir la toxicidad del fármaco o las reacciones adversas. [108]
Varios estudios han concluido que un período corto de sueño durante el día, una siesta energética , no tiene ningún efecto medible sobre los ritmos circadianos normales, pero puede disminuir el estrés y mejorar la productividad. [109] [110] [111]
Los problemas de salud pueden resultar de una alteración del ritmo circadiano. [112] Los ritmos circadianos también juegan un papel en el sistema de activación reticular , que es crucial para mantener un estado de conciencia. Una inversión [ aclaración necesaria ] en el ciclo sueño-vigilia puede ser un signo o complicación de uremia , [113] azotemia o lesión renal aguda . [114] [115]
Los estudios también han demostrado que la luz tiene un efecto directo sobre la salud humana debido a la forma en que influye en los ritmos circadianos. [116]
Iluminación interior
Los requisitos de iluminación para la regulación circadiana no son simplemente los mismos que los de la visión; La planificación de la iluminación interior en oficinas e instituciones comienza a tener esto en cuenta. [117] Los estudios en animales sobre los efectos de la luz en condiciones de laboratorio han considerado hasta hace poco la intensidad de la luz ( irradiancia ) pero no el color, que puede demostrarse que "actúa como un regulador esencial del tiempo biológico en entornos más naturales". [118]
Obesidad y diabetes
La obesidad y la diabetes están asociadas con el estilo de vida y factores genéticos. Entre esos factores, la interrupción del mecanismo de reloj circadiano y / o la desalineación del sistema de tiempo circadiano con el entorno externo (p. Ej., Ciclo de luz-oscuridad) podrían desempeñar un papel en el desarrollo de trastornos metabólicos. [112]
El trabajo por turnos o el desfase horario crónico tienen profundas consecuencias para los eventos circadianos y metabólicos en el cuerpo. Los animales que se ven obligados a comer durante su período de descanso muestran un aumento de la masa corporal y una expresión alterada de los genes metabólicos y del reloj. [119] [ cita médica necesaria ] En los seres humanos, el trabajo por turnos que favorece los horarios irregulares para comer se asocia con una alteración de la sensibilidad a la insulina y una mayor masa corporal. El trabajo por turnos también conduce a un aumento de los riesgos metabólicos de síndrome cardiometabólico, hipertensión e inflamación. [120]
Pilotos de líneas aéreas y tripulantes de cabina
Debido a la naturaleza laboral de los pilotos de aerolíneas, que a menudo cruzan varias zonas horarias y regiones de luz solar y oscuridad en un día, y pasan muchas horas despiertos tanto de día como de noche, a menudo no pueden mantener patrones de sueño que se correspondan con el circadiano humano natural. ritmo; esta situación puede provocar fatiga fácilmente . La NTSB cita que esto contribuyó a muchos accidentes [121] y ha realizado varios estudios de investigación con el fin de encontrar métodos para combatir la fatiga en los pilotos. [122]
Ruptura
La alteración de los ritmos suele tener un efecto negativo. Muchos viajeros han experimentado la afección conocida como desfase horario , con sus síntomas asociados de fatiga , desorientación e insomnio . [123]
Varios otros trastornos, por ejemplo el trastorno bipolar y algunos trastornos del sueño , como el trastorno de la fase de sueño retardada (DSPD), están asociados con el funcionamiento irregular o patológico de los ritmos circadianos. [124]
Se cree que la alteración de los ritmos a largo plazo tiene importantes consecuencias adversas para la salud de los órganos periféricos fuera del cerebro, en particular en el desarrollo o exacerbación de enfermedades cardiovasculares. [112] [125] La iluminación LED azul suprime la producción de melatonina cinco veces más que la luz de sodio de alta presión (HPS) de color amarillo anaranjado ; una lámpara de haluro metálico , que es de luz blanca, suprime la melatonina a un ritmo tres veces mayor que el HPS. [126] Los síntomas de depresión por exposición prolongada a la luz nocturna se pueden deshacer volviendo a un ciclo normal. [127]
Efecto de las drogas
Los estudios realizados tanto en animales como en humanos muestran importantes relaciones bidireccionales entre el sistema circadiano y las drogas abusivas. Se indica que estas drogas abusivas afectan el marcapasos circadiano central. Las personas que sufren de abuso de sustancias muestran ritmos alterados. Estos ritmos interrumpidos pueden aumentar el riesgo de abuso de sustancias y recaídas. Es posible que las alteraciones genéticas y / o ambientales del ciclo normal de sueño y vigilia puedan aumentar la susceptibilidad a la adicción. [128]
Es difícil determinar si una alteración en el ritmo circadiano tiene la culpa de un aumento en la prevalencia del abuso de sustancias o si la culpa es de otros factores ambientales como el estrés. Los cambios en el ritmo circadiano y el sueño ocurren una vez que una persona comienza a abusar de las drogas y el alcohol. Una vez que una persona decide dejar de consumir drogas y alcohol, el ritmo circadiano sigue alterado. [128]
La estabilización del sueño y el ritmo circadiano posiblemente podrían ayudar a reducir la vulnerabilidad a la adicción y reducir las posibilidades de recaída. [128]
Los ritmos circadianos y los genes del reloj expresados en regiones del cerebro fuera del núcleo supraquiasmático pueden influir significativamente en los efectos producidos por drogas como la cocaína . [ cita requerida ] Además, las manipulaciones genéticas de los genes del reloj afectan profundamente las acciones de la cocaína. [129]
sociedad y Cultura
En 2017, Jeffrey C. Hall , Michael W. Young y Michael Rosbash fueron galardonados con el Premio Nobel de Fisiología o Medicina "por sus descubrimientos de los mecanismos moleculares que controlan el ritmo circadiano". [130] [131]
Ver también
- Actigrafía (también conocida como actimetría)
- ARNTL
- ARNTL2
- Ritmos circadianos bacterianos
- Trastornos del ritmo circadiano del sueño , como
- Trastorno avanzado de la fase del sueño
- Trastorno de la fase tardía del sueño
- Trastorno de sueño-vigilia que no dura 24 horas
- Cronobiología
- RELOJ
- Ritmo circasemidiano
- Circaseptan , ciclo biológico de 7 días
- Criptocromo
- CRY1 y CRY2 : los genes de la familia de los criptocromos
- Ciclo diurno
- Efectos de luz sobre el ritmo circadiano
- Luz en edificios escolares
- PER1 , PER2 y PER3 : los genes de la familia del período
- Célula ganglionar fotosensible : parte del ojo que participa en la regulación del ritmo circadiano.
- Sueño polifásico
- Rev-ErbA alpha
- Sueño segmentado
- Arquitectura del sueño (sueño en humanos)
- Dormir en animales no humanos
- Stefania Follini
Referencias
- ^ "¿Qué nos hace dormir?" . NICHD: Instituto Nacional de Salud Infantil y Desarrollo Humano Eunice Kennedy Shriver . Consultado el 6 de mayo de 2019 .
- ^ a b Edgar RS, Green EW, Zhao Y, van Ooijen G, Olmedo M, Qin X, et al. (Mayo de 2012). "Las peroxiredoxinas son marcadores conservados de ritmos circadianos" . Naturaleza . 485 (7399): 459–64. Código Bibliográfico : 2012Natur.485..459E . doi : 10.1038 / nature11088 . PMC 3398137 . PMID 22622569 .
- ^ Vitaterna MH, Takahashi JS, Turek FW (2001). "Descripción general de los ritmos circadianos" . Investigación y salud sobre el alcohol . 25 (2): 85–93. PMC 6707128 . PMID 11584554 .
- ^ a b Bass J (noviembre de 2012). "Topología circadiana del metabolismo". Naturaleza . 491 (7424): 348–56. Código bibliográfico : 2012Natur.491..348B . doi : 10.1038 / nature11704 . PMID 23151577 . S2CID 27778254 .
- ^ Bretzl H (1903). Botanische Forschungen des Alexanderzuges . Leipzig: Teubner.[ página necesaria ]
- ^ Lu G (25 de octubre de 2002). Lancetas celestes . Prensa de psicología. págs. 137–140. ISBN 978-0-7007-1458-2.
- ↑ de Mairan JJ (1729). "Observación Botánica". Histoire de l'Académie Royale des Sciences : 35–36.
- ^ Gardner MJ, Hubbard KE, Hotta CT, Dodd AN, Webb AA (julio de 2006). "Cómo las plantas dicen la hora" . La revista bioquímica . 397 (1): 15-24. doi : 10.1042 / BJ20060484 . PMC 1479754 . PMID 16761955 .
- ^ Dijk DJ, von Schantz M (agosto de 2005). "Momento y consolidación del sueño humano, la vigilia y el rendimiento por una sinfonía de osciladores". Revista de ritmos biológicos . 20 (4): 279–90. doi : 10.1177 / 0748730405278292 . PMID 16077148 . S2CID 13538323 .
- ^ Danchin A. "Fechas importantes 1900-1919" . Centro de Investigación HKU-Pasteur . Archivado desde el original el 20 de octubre de 2003 . Consultado el 12 de enero de 2008 .
- ^ Antle MC, Silver R (noviembre de 2009). "Bases neuronales de la sincronización y los comportamientos anticipatorios" . La Revista Europea de Neurociencia . 30 (9): 1643–9. doi : 10.1111 / j.1460-9568.2009.06959.x . PMC 2929840 . PMID 19878281 .
- ^ Bruce VG, Pittendrigh CS (1957). "Ritmos endógenos en insectos y microorganismos". El naturalista estadounidense . 91 (858): 179-195. doi : 10.1086 / 281977 . S2CID 83886607 .
- ↑ a b Pittendrigh CS (1993). "Organización temporal: reflexiones de un reloj-observador darwiniano". Revisión anual de fisiología . 55 (1): 16–54. doi : 10.1146 / annurev.ph.55.030193.000313 . PMID 8466172 . S2CID 45054898 .
- ^ Pittendrigh CS (octubre de 1954). "Sobre la independencia de la temperatura en el sistema de reloj que controla el tiempo de aparición en Drosophila" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 40 (10): 1018–29. Código bibliográfico : 1954PNAS ... 40.1018P . doi : 10.1073 / pnas.40.10.1018 . PMC 534216 . PMID 16589583 .
- ^ Halberg F, Cornélissen G, Katinas G, Syutkina EV, Sothern RB, Zaslavskaya R, et al. (Octubre de 2003). "Implicaciones unificadoras transdisciplinarias de los hallazgos circadianos en la década de 1950" . Revista de ritmos circadianos . 1 (1): 2. doi : 10.1186 / 1740-3391-1-2 . PMC 317388 . PMID 14728726 .
Finalmente volví, por la misma razón, a "circadiano" ...
- ^ Halberg F (1959). "[Periodicidad fisiológica de 24 horas; consideraciones generales y de procedimiento con referencia al ciclo suprarrenal]". Internationale Zeitschrift für Vitaminforschung. Beiheft . 10 : 225–96. PMID 14398945 .
- ^ Koukkari WL, Sothern RB (2006). Introducción a los ritmos biológicos: una introducción a la organización temporal de la vida, con implicaciones para la salud, la sociedad, la reproducción y el medio ambiente natural . Nueva York: Springer. pag. 23. ISBN 978-1-4020-3691-0.
- ^ Halberg F, Carandente F, Cornelissen G, Katinas GS (1977). "[Glosario de cronobiología (traducción del autor)]". Chronobiologia . 4 Supl. 1: 1–189. PMID 352650 .
- ^ Konopka RJ, Benzer S (septiembre de 1971). "Reloj mutantes de Drosophila melanogaster" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 68 (9): 2112–6. Código bibliográfico : 1971PNAS ... 68.2112K . doi : 10.1073 / pnas.68.9.2112 . PMC 389363 . PMID 5002428 .
- ^ Reddy P, Zehring WA, Wheeler DA, Pirrotta V, Hadfield C, Hall JC, Rosbash M (octubre de 1984). "Análisis molecular del locus de período en Drosophila melanogaster e identificación de una transcripción involucrada en ritmos biológicos". Celular . 38 (3): 701–10. doi : 10.1016 / 0092-8674 (84) 90265-4 . PMID 6435882 . S2CID 316424 .
- ^ Zehring WA, Wheeler DA, Reddy P, Konopka RJ, Kyriacou CP, Rosbash M, Hall JC (diciembre de 1984). "La transformación del elemento P con el ADN del locus del período restaura la ritmicidad a la Drosophila melanogaster mutante y arrítmica" . Celular . 39 (2 Pt 1): 369–76. doi : 10.1016 / 0092-8674 (84) 90015-1 . PMID 6094014 .
- ^ Bargiello TA, Jackson FR, Young MW (1984). "Restauración de los ritmos de comportamiento circadianos por transferencia de genes en Drosophila". Naturaleza . 312 (5996): 752–4. Código bibliográfico : 1984Natur.312..752B . doi : 10.1038 / 312752a0 . PMID 6440029 . S2CID 4259316 .
- ^ Bargiello TA, Young MW (abril de 1984). "Genética molecular de un reloj biológico en Drosophila" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 81 (7): 2142–6. Código bibliográfico : 1984Natur.312..752B . doi : 10.1038 / 312752a0 . PMC 345453 . PMID 16593450 .
- ^ "El Premio Nobel de Fisiología o Medicina 2017" . www.nobelprize.org . Consultado el 6 de octubre de 2017 .
- ^ [ fuente médica no confiable? ] "Gen descubierto en ratones que regula el reloj biológico". Chicago Tribune . 29 de abril de 1994.
- ^ [se necesita fuente no primaria ] Vitaterna MH, King DP, Chang AM, Kornhauser JM, Lowrey PL, McDonald JD, et al. (Abril de 1994). "Mutagénesis y mapeo de un gen de ratón, Reloj, esencial para el comportamiento circadiano" . Ciencia . 264 (5159): 719-25. Bibcode : 1994Sci ... 264..719H . doi : 10.1126 / science.8171325 . PMC 3839659 . PMID 8171325 .
- ^ Debruyne JP, Noton E, Lambert CM, Maywood ES, Weaver DR, Reppert SM (mayo de 2006). "Un choque de reloj: el RELOJ del mouse no es necesario para la función del oscilador circadiano" . Neurona . 50 (3): 465–77. doi : 10.1016 / j.neuron.2006.03.041 . PMID 16675400 . S2CID 19028601 .
- ^ Collins B, Blau J (mayo de 2006). "Mantener el tiempo sin reloj" . Neurona . 50 (3): 348–50. doi : 10.1016 / j.neuron.2006.04.022 . PMID 16675389 .
- ^ Toh KL, Jones CR, He Y, Eide EJ, Hinz WA, Virshup DM, et al. (Febrero de 2001). "Una mutación del sitio de fosforilación de hPer2 en el síndrome familiar de fase avanzada del sueño" . Ciencia . 291 (5506): 1040–3. Código Bibliográfico : 2001Sci ... 291.1040T . doi : 10.1126 / science.1057499 . PMID 11232563 . S2CID 1848310 .
- ^ Jones CR, Campbell SS, Zona SE, Cooper F, DeSano A, Murphy PJ, et al. (Septiembre de 1999). "Síndrome de fase de sueño avanzada familiar: una variante del ritmo circadiano de período corto en humanos" . Medicina de la naturaleza . 5 (9): 1062–5. doi : 10.1038 / 12502 . PMID 10470086 . S2CID 14809619 .
- ^ Johnson C (2004). Cronobiología: cronometraje biológico . Sunderland, Massachusetts, EE.UU .: Sinauer Associates, Inc. págs. 67–105.
- ^ Sharma VK (noviembre de 2003). "Significado adaptativo de los relojes circadianos". Chronobiology International . 20 (6): 901-19. doi : 10.1081 / CBI-120026099 . PMID 14680135 . S2CID 10899279 .
- ^ [Se necesita fuente no primaria ] Sheeba V, Sharma VK, Chandrashekaran MK, Joshi A (septiembre de 1999). "Persistencia del ritmo de eclosión en Drosophila melanogaster después de 600 generaciones en un ambiente aperiódico". Die Naturwissenschaften . 86 (9): 448–9. Código Bibliográfico : 1999NW ..... 86..448S . doi : 10.1007 / s001140050651 . PMID 10501695 . S2CID 13401297 .
- ^ [se necesita fuente no primaria ] Guyomarc'h C, Lumineau S, Richard JP (mayo de 1998). "Ritmo circadiano de actividad en codornices japonesas en oscuridad constante: variabilidad de claridad y posibilidad de selección". Chronobiology International . 15 (3): 219-30. doi : 10.3109 / 07420529808998685 . PMID 9653576 .
- ^ [se necesita fuente no primaria ] Zivkovic BD, Underwood H, Steele CT, Edmonds K (octubre de 1999). "Propiedades formales de los sistemas circadiano y fotoperiódico de la codorniz japonesa: curva de respuesta de fase y efectos de los ciclos T". Revista de ritmos biológicos . 14 (5): 378–90. doi : 10.1177 / 074873099129000786 . PMID 10511005 . S2CID 13390422 .
- ^ Mori T, Johnson CH (abril de 2001). "Independencia del tiempo circadiano de la división celular en cianobacterias" . Revista de bacteriología . 183 (8): 2439–44. doi : 10.1128 / JB.183.8.2439-2444.2001 . PMC 95159 . PMID 11274102 .
- ^ Hut RA, Beersma DG (julio de 2011). "Evolución de los mecanismos de cronometraje: emergencia temprana y adaptación al fotoperiodo" . Transacciones filosóficas de la Royal Society de Londres. Serie B, Ciencias Biológicas . 366 (1574): 2141–54. doi : 10.1098 / rstb.2010.0409 . PMC 3130368 . PMID 21690131 .
- ^ Dubowy C, Sehgal A (abril de 2017). "Drosophila melanogaster" . Genética . 205 (4): 1373-1397. doi : 10.1534 / genetics.115.185157 . PMC 5378101 . PMID 28360128 .
- ^ [ fuente médica no confiable? ] Nagoshi E, Saini C, Bauer C, Laroche T, Naef F, Schibler U (noviembre de 2004). "Expresión génica circadiana en fibroblastos individuales: osciladores autónomos y autosostenidos de células pasan el tiempo a las células hijas" . Celular . 119 (5): 693–705. doi : 10.1016 / j.cell.2004.11.015 . PMID 15550250 . S2CID 15633902 .
- ^ [se necesita fuente no primaria ] Michel S, Geusz ME, Zaritsky JJ, Block GD (enero de 1993). "Ritmo circadiano en la conductancia de la membrana expresada en neuronas aisladas" . Ciencia . 259 (5092): 239–41. Código Bibliográfico : 1993Sci ... 259..239M . doi : 10.1126 / science.8421785 . PMID 8421785 .
- ^ Refinetti R (enero de 2010). "El ritmo circadiano de la temperatura corporal". Fronteras en biociencias . 15 (3): 564–94. doi : 10.2741 / 3634 . PMID 20036834 . S2CID 36170900 .
- ^ Scheer FA, Morris CJ, Shea SA (marzo de 2013). "El reloj circadiano interno aumenta el hambre y el apetito por la noche independientemente de la ingesta de alimentos y otros comportamientos" . La obesidad . 21 (3): 421–3. doi : 10.1002 / oby.20351 . PMC 3655529 . PMID 23456944 .
- ^ [ fuente médica no confiable? ] Zivkovic BC (25 de julio de 2007). "Tutorial de reloj # 16: Fotoperiodismo - Modelos y enfoques experimentales (trabajo original del 13-08-2005)" . Un blog las 24 horas del día . ScienceBlogs. Archivado desde el original el 1 de enero de 2008 . Consultado el 9 de diciembre de 2007 .
- ^ [se necesita fuente no primaria ] Turek FW, Joshu C, Kohsaka A, Lin E, Ivanova G, McDearmon E, et al. (Mayo de 2005). "Obesidad y síndrome metabólico en ratones mutantes del reloj circadiano" . Ciencia . 308 (5724): 1043–5. Código Bibliográfico : 2005Sci ... 308.1043T . doi : 10.1126 / science.1108750 . PMC 3764501 . PMID 15845877 .
- ^ Delezie J, Dumont S, Dardente H, Oudart H, Gréchez-Cassiau A, Klosen P, et al. (Agosto 2012). "El receptor nuclear REV-ERBα es necesario para el equilibrio diario del metabolismo de carbohidratos y lípidos". Revista FASEB . 26 (8): 3321–35. doi : 10.1096 / fj.12-208751 . PMID 22562834 . S2CID 31204290 .
- ^ [se necesita fuente no primaria ] Delezie J, Dumont S, Dardente H, Oudart H, Gréchez-Cassiau A, Klosen P, et al. (Agosto 2012). "El receptor nuclear REV-ERBα es necesario para el equilibrio diario del metabolismo de carbohidratos y lípidos". Revista FASEB . 26 (8): 3321–35. doi : 10.1096 / fj.12-208751 . PMID 22562834 . S2CID 31204290 .
- ^ [ fuente no primaria necesaria ] Scott EM, Carter AM, Grant PJ (abril de 2008). "Asociación entre polimorfismos en el gen Clock, obesidad y síndrome metabólico en el hombre" . Revista Internacional de Obesidad . 32 (4): 658–62. doi : 10.1038 / sj.ijo.0803778 . PMID 18071340 .
- ^ [ fuente médica no confiable? ] Shneerson JM, Ohayon MM, Carskadon MA (2007). "Ritmos circadianos" . Sueño de movimientos oculares rápidos (REM) . Red Médica Armenia . Consultado el 19 de septiembre de 2007 .
- ^ "Los ritmos de la vida: los relojes biológicos que controlan la vida diaria de todos los seres vivos" Russell Foster & Leon Kreitzman, editor: Profile Books Ltd.
- ^ [ fuente médica no confiable? ] Regestein QR, Pavlova M (septiembre de 1995). "Tratamiento del síndrome de la fase tardía del sueño". Psiquiatría Hospitalaria General . 17 (5): 335–45. doi : 10.1016 / 0163-8343 (95) 00062-V . PMID 8522148 .
- ^ Howell E (14 de diciembre de 2012). "Estación espacial para obtener nuevas bombillas para combatir el insomnio" . Consultado el 17 de diciembre de 2012 .
- ^ [se necesita fuente no primaria ] Spilde I (diciembre de 2005). "Reinsdyr uten døgnrytme" (en noruego bokmål). forskning.no. Archivado desde el original el 3 de diciembre de 2007 . Consultado el 24 de noviembre de 2007 .
... så det ikke ut til at reinen hadde noen døgnrytme om sommeren. Svalbardreinen hadde det heller ikke om vinteren.
- ↑ Folk GE, Thrift DL, Zimmerman MB, Reimann P (1 de diciembre de 2006). "Actividad de mamíferos - ritmos de descanso en la luz diurna continua del Ártico". Investigación del ritmo biológico . 37 (6): 455–469. doi : 10.1080 / 09291010600738551 . S2CID 84625255 .
¿Los animales locales mantenidos bajo luz natural continua demostrarían el efecto Aschoff descrito en experimentos de laboratorio publicados anteriormente utilizando luz continua, en los que los patrones de actividad circadiana de las ratas cambiaban sistemáticamente a un período más largo, expresando un día de actividad y descanso de 26 horas?
- ^ [se necesita fuente no primaria ] Merlin C, Gegear RJ, Reppert SM (septiembre de 2009). "Los relojes circadianos de antena coordinan la orientación de la brújula solar en las mariposas monarca migratorias" . Ciencia . 325 (5948): 1700-4. Código Bibliográfico : 2009Sci ... 325.1700M . doi : 10.1126 / science.1176221 . PMC 2754321 . PMID 19779201 .
- ^ [se necesita fuente no primaria ] Kyriacou CP (septiembre de 2009). "Fisiología. Desentrañar viajando". Ciencia . 325 (5948): 1629–30. doi : 10.1126 / science.1178935 . PMID 19779177 . S2CID 206522416 .
- ^ Silvegren G, Löfstedt C, Qi Rosén W (marzo de 2005). "Actividad de apareamiento circadiano y efecto de la preexposición de feromonas sobre los ritmos de respuesta de feromonas en la polilla Spodoptera littoralis". Revista de fisiología de insectos . 51 (3): 277–86. doi : 10.1016 / j.jinsphys.2004.11.013 . PMID 15749110 .
- ↑ a b Webb AA (junio de 2003). "La fisiología de los ritmos circadianos en las plantas". Nuevo fitólogo . 160 (2): 281-303. doi : 10.1046 / j.1469-8137.2003.00895.x . JSTOR 1514280 . PMID 33832173 . S2CID 15688409 .
- ↑ a b c McClung CR (abril de 2006). "Planta de ritmos circadianos" . La célula vegetal . 18 (4): 792–803. doi : 10.1105 / tpc.106.040980 . PMC 1425852 . PMID 16595397 .
- ^ Mizoguchi T, Wright L, Fujiwara S, Cremer F, Lee K, Onouchi H, et al. (Agosto de 2005). "Funciones distintas de GIGANTEA en la promoción de la floración y la regulación de los ritmos circadianos en Arabidopsis" . La célula vegetal . 17 (8): 2255–70. doi : 10.1105 / tpc.105.033464 . PMC 1182487 . PMID 16006578 .
- ^ Kolmos E, Davis SJ (septiembre de 2007). "ELF4 como gen central en el reloj circadiano" . Señalización y comportamiento de la planta . 2 (5): 370–2. doi : 10.4161 / psb.2.5.4463 . PMC 2634215 . PMID 19704602 .
- ^ Pokhilko A, Fernández AP, Edwards KD, Southern MM, Halliday KJ, Millar AJ (marzo de 2012). "El circuito del gen del reloj en Arabidopsis incluye un represor con bucles de retroalimentación adicionales" . Biología de sistemas moleculares . 8 : 574. doi : 10.1038 / msb.2012.6 . PMC 3321525 . PMID 22395476 .
- ^ Ma Y, Gil S, Grasser KD, Mas P (abril de 2018). "Reclutamiento dirigido de la maquinaria de transcripción basal por componentes de reloj LNK controla los ritmos circadianos de los ARN nacientes en Arabidopsis" . La célula vegetal . 30 (4): 907–924. doi : 10.1105 / tpc.18.00052 . PMC 5973845 . PMID 29618629 .
- ↑ a b c d e f g h i j Dodd AN, Salathia N, Hall A, Kévei E, Tóth R, Nagy F, Webb AA (2005). "Los relojes circadianos de las plantas aumentan la fotosíntesis, el crecimiento, la supervivencia y la ventaja competitiva". Ciencia . 309 (5734): 630–633. Código bibliográfico : 2005Sci ... 309..630D . doi : 10.1126 / science.1115581 . PMID 16040710 . S2CID 25739247 . CS1 maint: varios nombres: lista de autores ( enlace )
- ↑ a b c d e Dodd AN, Belbin FE, Frank A, Webb AA (2015). "Interacciones entre los relojes circadianos y la fotosíntesis para la coordinación temporal y espacial del metabolismo" . Fronteras en la ciencia de las plantas . 6 : 245. doi : 10.3389 / fpls.2015.00245 . PMC 4391236 . PMID 25914715 . CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Webb AA, Seki M, Satake A, Caldana C (2019). "Ajuste dinámico continuo del oscilador circadiano de la planta" . Comunicaciones de la naturaleza . 10 (1): 550. Bibcode : 2019NatCo..10..550W . doi : 10.1038 / s41467-019-08398-5 . PMC 6358598 . PMID 30710080 . CS1 maint: varios nombres: lista de autores ( enlace )
- ↑ a b Haydon MJ, Mielczarek O, Robertson FC, Hubbard KE, Webb AA (2013). "Arrastre fotosintético del reloj circadiano de Arabidopsis thaliana" . Naturaleza . 502 (7473): 689–692. Código bibliográfico : 2013Natur.502..689H . doi : 10.1038 / nature12603 . PMC 3827739 . PMID 24153186 . CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Farré EM, Kay SA (2007). "Los niveles de proteína PRR7 están regulados por la luz y el reloj circadiano en Arabidopsis" . The Plant Journal . 52 (3): 548–560. doi : 10.1111 / j.1365-313X.2007.03258.x . PMID 17877705 .
- ^ Veleri S, Wülbeck C (mayo de 2004). "Osciladores circadianos autosostenidos únicos dentro del cerebro de Drosophila melanogaster". Chronobiology International . 21 (3): 329–42. doi : 10.1081 / CBI-120038597 . PMID 15332440 . S2CID 15099796 .
- ↑ Yoshii T, Hermann-Luibl C, Helfrich-Förster C (2015). "Vías de entrada de luz circadiana en Drosophila" . Biología comunicativa e integrativa . 9 (1): e1102805. doi : 10.1080 / 19420889.2015.1102805 . PMC 4802797 . PMID 27066180 .
- ^ Boothroyd CE, Joven MW (2008). "Las entradas y salidas del reloj circadiano de Drosophila". Anales de la Academia de Ciencias de Nueva York . 1129 (1): 350–7. Código bibliográfico : 2008NYASA1129..350B . doi : 10.1196 / annals.1417.006 . PMID 18591494 . S2CID 2639040 .
- ^ Grima B, Lamouroux A, Chélot E, Papin C, Limbourg-Bouchon B, Rouyer F (noviembre de 2002). "La proteína F-box slimb controla los niveles de proteínas de reloj de forma intemporal". Naturaleza . 420 (6912): 178–82. Código Bibliográfico : 2002Natur.420..178G . doi : 10.1038 / nature01122 . PMID 12432393 . S2CID 4428779 .
- ^ Ko HW, Jiang J, Edery I (diciembre de 2002). "Papel de Slimb en la degradación de la proteína del período Drosophila fosforilada por Doubletime". Naturaleza . 420 (6916): 673–8. Código Bibliográfico : 2002Natur.420..673K . doi : 10.1038 / nature01272 . PMID 12442174 . S2CID 4414176 .
- ^ Helfrich-Förster C (marzo de 2005). "Neurobiología del reloj circadiano de la mosca de la fruta". Genes, cerebro y comportamiento . 4 (2): 65–76. doi : 10.1111 / j.1601-183X.2004.00092.x . PMID 15720403 . S2CID 26099539 .
- ^ Lalchhandama K (2017). "El camino hacia el Premio Nobel de Fisiología o Medicina 2017" . Visión de la ciencia . 3 (Supl.): 1–13.
- ↑ a b c Leloup JC, Goldbeter A (febrero de 1998). "Un modelo de ritmos circadianos en Drosophila que incorpora la formación de un complejo entre las proteínas PER y TIM". Revista de ritmos biológicos . 13 (1): 70–87. doi : 10.1177 / 074873098128999934 . PMID 9486845 . S2CID 17944849 .
- ^ Goldbeter A (septiembre de 1995). "Un modelo de oscilaciones circadianas en la proteína del período de Drosophila (PER)". Actas. Ciencias Biológicas . 261 (1362): 319–24. Código Bibliográfico : 1995RSPSB.261..319G . doi : 10.1098 / rspb.1995.0153 . PMID 8587874 . S2CID 7024361 .
- ↑ a b Goldbeter A (noviembre de 2002). "Aproximaciones computacionales a los ritmos celulares". Naturaleza . 420 (6912): 238–45. Código Bibliográfico : 2002Natur.420..238G . doi : 10.1038 / nature01259 . PMID 12432409 . S2CID 452149 .
- ^ "Reloj biológico en mamíferos" . BioInteractive . Instituto Médico Howard Hughes . Consultado el 5 de mayo de 2015 .
- ^ Galés DK, Takahashi JS, Kay SA (marzo de 2010). "Núcleo supraquiasmático: autonomía celular y propiedades de la red" . Revisión anual de fisiología . 72 : 551–77. doi : 10.1146 / annurev-fisiol-021909-135919 . PMC 3758475 . PMID 20148688 .
- ^ Pfeffer M, Korf HW, Wicht H (marzo de 2018). "Efectos de sincronización de la melatonina sobre los ritmos diurnos y circadianos". Endocrinología general y comparada . 258 : 215-221. doi : 10.1016 / j.ygcen.2017.05.013 . PMID 28533170 .
- ^ Kalpesh J. "Bienestar con luz artificial" . Consultado el 11 de enero de 2016 .
- ^ [ fuente médica no confiable? ] Scheer FA, Wright KP, Kronauer RE, Czeisler CA (agosto de 2007). "Plasticidad del período intrínseco del sistema de tiempo circadiano humano" . PLOS ONE . 2 (8): e721. Código Bibliográfico : 2007PLoSO ... 2..721S . doi : 10.1371 / journal.pone.0000721 . PMC 1934931 . PMID 17684566 .
- ^ [ fuente médica no confiable? ] Duffy JF, Wright KP (agosto de 2005). "Arrastre del sistema circadiano humano por la luz". Revista de ritmos biológicos . 20 (4): 326–38. doi : 10.1177 / 0748730405277983 . PMID 16077152 . S2CID 20140030 .
- ^ Khalsa SB, Jewett ME, Cajochen C, Czeisler CA (junio de 2003). "Una curva de respuesta de fase a pulsos de luz brillante individuales en sujetos humanos" . La revista de fisiología . 549 (Pt 3): 945–52. doi : 10.1113 / jphysiol.2003.040477 . PMC 2342968 . PMID 12717008 .
- ↑ Cromie W (15 de julio de 1999). "Reloj biológico humano retrasado una hora" . Harvard Gazette . Consultado el 4 de julio de 2015 .
- ^ a b Duffy JF, Cain SW, Chang AM, Phillips AJ, Münch MY, Gronfier C, et al. (Septiembre de 2011). "Diferencia de sexo en el período intrínseco de casi 24 horas del sistema de tiempo circadiano humano" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 Suplemento 3 (Suplemento_3): 15602–8. Código bibliográfico : 2011PNAS..10815602D . doi : 10.1073 / pnas.1010666108 . PMC 3176605 . PMID 21536890 .
- ↑ a b c Benloucif S, Guico MJ, Reid KJ, Wolfe LF, L'hermite-Balériaux M, Zee PC (abril de 2005). "Estabilidad de la melatonina y la temperatura como marcadores de fase circadiana y su relación con los tiempos de sueño en humanos". Revista de ritmos biológicos . 20 (2): 178–88. doi : 10.1177 / 0748730404273983 . PMID 15834114 . S2CID 36360463 .
- ^ Adam EK, Quinn ME, Tavernier R, McQuillan MT, Dahlke KA, Gilbert KE (septiembre de 2017). "Pendientes de cortisol diurnas y resultados de salud física y mental: una revisión sistemática y metanálisis" . Psiconeuroendocrinología . 83 : 25–41. doi : 10.1016 / j.psyneuen.2017.05.018 . PMC 5568897 . PMID 28578301 .
- ^ Baehr EK, Revelle W, Eastman CI (junio de 2000). "Diferencias individuales en la fase y amplitud del ritmo de la temperatura circadiana humana: con énfasis en la mañana-tarde" . Revista de investigación del sueño . 9 (2): 117–27. doi : 10.1046 / j.1365-2869.2000.00196.x . PMID 10849238 . S2CID 6104127 .
- ^ "Taller de NHLBI:" Reloj circadiano en la interfaz de la salud y la enfermedad pulmonar "28-29 de abril de 2014 Resumen ejecutivo" . Instituto Nacional del Corazón, los Pulmones y la Sangre. Septiembre de 2014. Archivado desde el original el 4 de octubre de 2014 . Consultado el 20 de septiembre de 2014 .
- ^ Degaute JP, van de Borne P, Linkowski P, Van Cauter E (agosto de 1991). "Análisis cuantitativo de los patrones de presión arterial y frecuencia cardíaca de 24 horas en hombres jóvenes" . La hipertensión . 18 (2): 199–210. doi : 10.1161 / 01.hyp.18.2.199 . PMID 1885228 .
- ^ Quartel L (2014). "El efecto del ritmo circadiano de la temperatura corporal en el rendimiento del examen de nivel A" . Revista de Licenciatura en Psicología . 27 (1).
- ^ Mohawk JA, Green CB, Takahashi JS (14 de julio de 2013). "Relojes circadianos centrales y periféricos en mamíferos" . Revisión anual de neurociencia . 35 : 445–62. doi : 10.1146 / annurev-neuro-060909-153128 . PMC 3710582 . PMID 22483041 .
- ^ Id.
- ^ Pendergast JS, Niswender KD, Yamazaki S (11 de enero de 2012). "Función específica de tejido de Period3 en ritmicidad circadiana" . PLOS ONE . 7 (1): e30254. Código bibliográfico : 2012PLoSO ... 730254P . doi : 10.1371 / journal.pone.0030254 . PMC 3256228 . PMID 22253927 .
- ^ Singh M (10 de octubre de 2013). "El sentido del tiempo de nuestra piel ayuda a proteger contra el daño de los rayos UV" . NPR . Consultado el 19 de febrero de 2019 .
- ^ Abraham U, Granada AE, Westermark PO, Heine M, Kramer A, Herzel H (noviembre de 2010). "El acoplamiento gobierna el rango de arrastre de los relojes circadianos" . Biología de sistemas moleculares . 6 : 438. doi : 10.1038 / msb.2010.92 . PMC 3010105 . PMID 21119632 .
- ^ Cao Q, Gery S, Dashti A, Yin D, Zhou Y, Gu J, Koeffler HP (octubre de 2009). "Un papel del gen del reloj per1 en el cáncer de próstata" . Investigación del cáncer . 69 (19): 7619-25. doi : 10.1158 / 0008-5472.CAN-08-4199 . PMC 2756309 . PMID 19752089 .
- ^ Kawara S, Mydlarski R, Mamelak AJ, Liberado I, Wang B, Watanabe H, et al. (Diciembre de 2002). "Los rayos ultravioleta B de dosis baja alteran la expresión del ARNm de los genes del reloj circadiano en queratinocitos humanos cultivados" . The Journal of Investigative Dermatology . 119 (6): 1220–3. doi : 10.1046 / j.1523-1747.2002.19619.x . PMID 12485420 .
- ^ Damiola F, Le Minh N, Preitner N, Kornmann B, Fleury-Olela F, Schibler U (diciembre de 2000). "La alimentación restringida desacopla los osciladores circadianos en los tejidos periféricos del marcapasos central en el núcleo supraquiasmático" . Genes y desarrollo . 14 (23): 2950–61. doi : 10.1101 / gad.183500 . PMC 317100 . PMID 11114885 .
- ^ Duffy JF, Czeisler CA (junio de 2009). "Efecto de la luz sobre la fisiología circadiana humana" . Clínicas de Medicina del Sueño . 4 (2): 165-177. doi : 10.1016 / j.jsmc.2009.01.004 . PMC 2717723 . PMID 20161220 .
- ^ Czeisler CA, Duffy JF, Shanahan TL, Brown EN, Mitchell JF, Rimmer DW, et al. (Junio de 1999). "Estabilidad, precisión y período de casi 24 horas del marcapasos circadiano humano". Ciencia . 284 (5423): 2177–81. doi : 10.1126 / science.284.5423.2177 . PMID 10381883 .
- ^ Aldrich MS (1999). Medicina del sueño . Nueva York: Oxford University Press. ISBN 978-0-19-512957-1.
- ^ Wyatt JK, Ritz-De Cecco A, Czeisler CA, Dijk DJ (octubre de 1999). "Ritmos de temperatura circadiana y melatonina, sueño y función neuroconductual en humanos que viven en un día de 20 h". La Revista Estadounidense de Fisiología . 277 (4 Pt 2): R1152-63. doi : 10.1152 / ajpregu.1999.277.4.R1152 . PMID 10516257 . S2CID 4474347 .
- ^ Wright KP, Hull JT, Czeisler CA (diciembre de 2002). "Relación entre estado de alerta, rendimiento y temperatura corporal en humanos". Revista estadounidense de fisiología. Fisiología reguladora, integradora y comparada . 283 (6): R1370-7. CiteSeerX 10.1.1.1030.9291 . doi : 10.1152 / ajpregu.00205.2002 . PMID 12388468 .
- ^ Zhou X, Ferguson SA, Matthews RW, Sargent C, Darwent D, Kennaway DJ, Roach GD (julio de 2011). "Cambios dependientes del sueño, vigilia y fase en la función neuroconductual bajo desincronía forzada" . Duerme . 34 (7): 931–41. doi : 10.5665 / SLEEP.1130 . PMC 3119835 . PMID 21731143 .
- ^ Kosmadopoulos A, Sargent C, Darwent D, Zhou X, Dawson D, Roach GD (diciembre de 2014). "Los efectos de un horario de sueño-vigilia dividido en el rendimiento neuroconductual y las predicciones del rendimiento en condiciones de desincronía forzada". Chronobiology International . 31 (10): 1209–17. doi : 10.3109 / 07420528.2014.957763 . PMID 25222348 . S2CID 11643058 .
- ^ Grote L, Mayer J, Penzel T, Cassel W, Krzyzanek E, Peter JH, von Wichert P (1994). "Hipertensión arterial nocturna y riesgo cardiovascular: consecuencias para el diagnóstico y tratamiento". Revista de farmacología cardiovascular . 24 Suppl 2: S26-38. PMID 7898092 .
- ↑ Hershner SD, Chervin RD (23 de junio de 2014). "Causas y consecuencias de la somnolencia entre estudiantes universitarios" . Naturaleza y ciencia del sueño . 6 : 73–84. doi : 10.2147 / NSS.S62907 . PMC 4075951 . PMID 25018659 .
- ^ Milner CE, Cote KA (junio de 2009). "Beneficios de la siesta en adultos sanos: impacto de la duración de la siesta, la hora del día, la edad y la experiencia con la siesta" . Revista de investigación del sueño . 18 (2): 272–81. doi : 10.1111 / j.1365-2869.2008.00718.x . PMID 19645971 . S2CID 22815227 .
- ^ Lovato N, Falta L (2010). Los efectos de la siesta en el funcionamiento cognitivo . Progresos en la investigación del cerebro. 185 . págs. 155-166. doi : 10.1016 / B978-0-444-53702-7.00009-9 . ISBN 978-0-444-53702-7. PMID 21075238 .
- ^ a b c Zelinski EL, Deibel SH, McDonald RJ (marzo de 2014). "El problema con la disfunción del reloj circadiano: múltiples efectos nocivos sobre el cerebro y el cuerpo". Revisiones de neurociencia y bioconducta . 40 (40): 80–101. doi : 10.1016 / j.neubiorev.2014.01.007 . PMID 24468109 . S2CID 6809964 .
- ^ Sinert T, Peacock PR (10 de mayo de 2006). "Insuficiencia renal aguda" . eMedicine de WebMD . Consultado el 3 de agosto de 2008 .
- ^ Maung SC, El Sara A, Chapman C, Cohen D, Cukor D (mayo de 2016). "Trastornos del sueño y enfermedad renal crónica" . Revista mundial de nefrología . 5 (3): 224–32. doi : 10.5527 / wjn.v5.i3.224 . PMC 4848147 . PMID 27152260 .
- ^ Nakano S, Uchida K, Kigoshi T, Azukizawa S, Iwasaki R, Kaneko M, Morimoto S (agosto de 1991). "Ritmo circadiano de la presión arterial en sujetos normotensos NIDDM. Su relación con las complicaciones microvasculares". Cuidado de la diabetes . 14 (8): 707-11. doi : 10.2337 / diacare.14.8.707 . PMID 1954805 . S2CID 12489921 .
- ^ Figueiro MG, Rea MS, Bullough JD (agosto de 2006). "¿Contribuye la iluminación arquitectónica al cáncer de mama?" . Revista de carcinogénesis . 5 : 20. doi : 10.1186 / 1477-3163-5-20 . PMC 1557490 . PMID 16901343 .
- ^ Rea MS, Figueiro M, Bullough J (mayo de 2002). "Fotobiología circadiana: un marco emergente para la práctica y la investigación de la iluminación". Investigación y tecnología de iluminación . 34 (3): 177–187. doi : 10.1191 / 1365782802lt057oa . S2CID 109776194 .
- ^ Walmsley L, Hanna L, Mouland J, Martial F, West A, Smedley AR, et al. (Abril de 2015). "El color como una señal para sincronizar el reloj circadiano de los mamíferos" . PLOS Biología . 13 (4): e1002127. doi : 10.1371 / journal.pbio.1002127 . PMC 4401556 . PMID 25884537 .
- ^ Johnston JD (junio de 2014). "Respuestas fisiológicas a la ingesta de alimentos a lo largo del día" . Revisiones de investigación nutricional . 27 (1): 107–18. doi : 10.1017 / S0954422414000055 . PMC 4078443 . PMID 24666537 .
- ^ Delezie J, Challet E (diciembre de 2011). "Interacciones entre el metabolismo y los relojes circadianos: alteraciones recíprocas" . Anales de la Academia de Ciencias de Nueva York . 1243 (1): 30–46. Código bibliográfico : 2011NYASA1243 ... 30D . doi : 10.1111 / j.1749-6632.2011.06246.x . PMID 22211891 . S2CID 43621902 .
- ^ [1] [ enlace muerto ]
- ^ Interrupción del ritmo circadiano y vuelo. FAA en https://www.faa.gov/pilots/safety/pilotsafetybrochures/media/Circadian_Rhythm.pdf
- ^ "Trastorno de desfase horario - síntomas y causas" . Mayo Clinic . Consultado el 1 de febrero de 2019 .
- ^ Zhu L, Zee PC (noviembre de 2012). "Trastornos del sueño del ritmo circadiano" . Clínicas neurológicas . 30 (4): 1167–91. doi : 10.1016 / j.ncl.2012.08.011 . PMC 3523094 . PMID 23099133 .
- ^ Oritz-Tuldela E, Martinez-Nicolas A, Diaz-Mardomingo C, Garcia-Herranz S, Pereda-Perez I, Valencia A, Peraita H, Venero C, Madrid J, Rol M. 2014. La caracterización de ritmos biológicos en leves Deterioro cognitivo. BioMed Research International.
- ↑ Hardt R (1 de enero de 1970). "Los peligros de la luz LED-azul-la supresión de melatonina-resultantes de insomnio-y cánceres | Robert Hardt" . Academia.edu . Consultado el 24 de diciembre de 2016 .
- ^ Bedrosian TA, Nelson RJ (enero de 2017). "El tiempo de exposición a la luz afecta el estado de ánimo y los circuitos cerebrales" . Psiquiatría traslacional . 7 (1): e1017. doi : 10.1038 / tp.2016.262 . PMC 5299389 . PMID 28140399 .
- ^ a b c Logan RW, Williams WP, McClung CA (junio de 2014). "Ritmos circadianos y adicción: conocimientos mecanicistas y direcciones futuras" . Neurociencia del comportamiento . 128 (3): 387–412. doi : 10.1037 / a0036268 . PMC 4041815 . PMID 24731209 .
- ^ Prosser RA, Glass JD (junio de 2015). "Evaluación de las acciones del etanol en el reloj circadiano supraquiasmático utilizando enfoques in vivo e in vitro" . Alcohol . 49 (4): 321–339. doi : 10.1016 / j.alcohol.2014.07.016 . PMC 4402095 . PMID 25457753 .
- ^ Cha AE (2 de octubre de 2017). "Nobel de fisiología, medicina otorgada a tres estadounidenses por el descubrimiento de 'genes reloj ' " . The Washington Post . Consultado el 2 de octubre de 2017 .
- ^ "El Premio Nobel de Fisiología o Medicina 2017 - Comunicado de prensa" . La Fundación Nobel. 2 de octubre de 2017 . Consultado el 2 de octubre de 2017 .
Otras lecturas
- Aschoff J, ed. (1965). Relojes circadianos . Ámsterdam: North Holland Press.
- Avivi A, Albrecht U, Oster H, Joel A, Beiles A, Nevo E (noviembre de 2001). "Reloj biológico en la oscuridad total: el sistema circadiano Reloj / MOP3 de la rata topo subterránea ciega" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (24): 13751–6. Código bibliográfico : 2001PNAS ... 9813751A . doi : 10.1073 / pnas.181484498 . PMC 61113 . PMID 11707566 .
- Avivi A, Oster H, Joel A, Beiles A, Albrecht U, Nevo E (septiembre de 2002). "Genes circadianos en un mamífero subterráneo ciego II: conservación y singularidad de los homólogos de tres períodos en la rata topo subterránea ciega, superespecie Spalax ehrenbergi" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (18): 11718–23. Código bibliográfico : 2002PNAS ... 9911718A . doi : 10.1073 / pnas.182423299 . PMC 129335 . PMID 12193657 .
- Li D, Ma S, Guo D, Cheng T, Li H, Tian Y, et al. (Octubre de 2016). "La alteración circadiana ambiental empeora el deterioro neurológico e inhibe la neurogénesis del hipocampo en ratas adultas después de una lesión cerebral traumática" . Neurobiología celular y molecular . 36 (7): 1045–55. doi : 10.1007 / s10571-015-0295-2 . PMC 4967018 . PMID 26886755 .
- Ditty JL, Williams SB, Golden SS (2003). "Un mecanismo de sincronización circadiana de cianobacterias". Revisión anual de genética . 37 : 513–43. doi : 10.1146 / annurev.genet.37.110801.142716 . PMID 14616072 . S2CID 36703896 .
- Dunlap JC, Loros J, DeCoursey PJ (2003). Cronobiología: cronometraje biológico . Sunderland: Sinauer. ISBN 9780878931491.
- Dvornyk V, Vinogradova O, Nevo E (marzo de 2003). "Origen y evolución de los genes del reloj circadiano en procariotas" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (5): 2495–500. Código bibliográfico : 2003PNAS..100.2495D . doi : 10.1073 / pnas.0130099100 . PMC 151369 . PMID 12604787 .
- Koukkari WL, Sothern RB (2006). Introduciendo ritmos biológicos . Nueva York: Springer.
- Martino T, Arab S, Straume M, Belsham DD, Tata N, Cai F, et al. (Abril de 2004). "Ritmos día / noche en la expresión génica del corazón murino normal". Revista de Medicina Molecular . 82 (4): 256–64. doi : 10.1007 / s00109-003-0520-1 . PMID 14985853 . S2CID 871822 .
- Refinetti R (2006). Fisiología circadiana (2ª ed.). Boca Ratón: CRC Press.
- Takahashi JS, Zatz M (septiembre de 1982). "Regulación de la ritmicidad circadiana". Ciencia . 217 (4565): 1104-11. Código Bibliográfico : 1982Sci ... 217.1104T . doi : 10.1126 / science.6287576 . PMID 6287576 .
- Tomita J, Nakajima M, Kondo T, Iwasaki H (enero de 2005). "No hay retroalimentación de transcripción-traducción en el ritmo circadiano de la fosforilación de KaiC". Ciencia . 307 (5707): 251–4. Código bibliográfico : 2005Sci ... 307..251T . doi : 10.1126 / science.1102540 . PMID 15550625 . S2CID 9447128 .
- Moore-Ede MC, Sulzman FM, Fuller CA (1982). Los relojes que nos cronometran: fisiología del sistema de cronometraje circadiano . Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-674-13581-9.
enlaces externos
| Wikimedia Commons tiene medios relacionados con el ritmo circadiano . |
- Ritmo circadiano en Curlie
- Ritmo circadiano
- Dormir
- Biología del trastorno bipolar
- Cognición vegetal