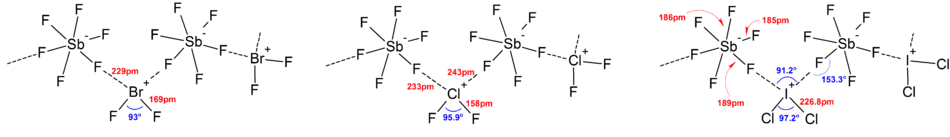Iones polihalogenados
Los iones poliológenos son un grupo de cationes poliatómicos y aniones que contienen solo halógenos . Los iones se pueden clasificar en dos clases, iones isopolihalógeno que contienen un solo tipo de halógeno e iones heteropolihalogen con más de un tipo de halógeno.
Se han encontrado numerosos iones polihalogenados, con sus sales aisladas en estado sólido y caracterizadas estructuralmente. Las siguientes tablas resumen las especies encontradas hasta ahora. [1] [2] [3] [4] [5]
La mayoría de las estructuras de los iones se han determinado por espectroscopia IR , espectroscopia Raman y cristalografía de rayos X . Los iones polihalogenados siempre tienen el halógeno más pesado y menos electronegativo presente en el ion como átomo central, lo que hace que el ion sea asimétrico en algunos casos. Por ejemplo, [Cl 2 F] + tiene una estructura de [Cl – Cl – F] - pero no [Cl – F – Cl] - .
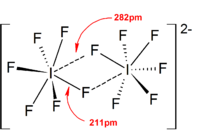
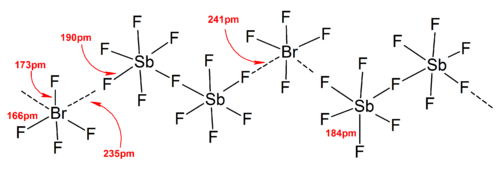
En general, las estructuras de la mayoría de los iones de homopolihalogen y de los iones de isopolihalogen inferior estaban de acuerdo con el modelo VSEPR . Sin embargo, hubo casos excepcionales. Por ejemplo, cuando el átomo central es pesado y tiene siete pares solitarios , como [BrF 6 ] - y [IF 6 ] - , tienen una disposición octaédrica regular de ligandos de fluoruro en lugar de uno distorsionado debido a la presencia de un estereoquímicamente par solitario inerte . Se encontraron más desviaciones del modelo VSEPR ideal en las estructuras de estado sólido debido a fuertes interacciones catión-anión, lo que también complica la interpretación de la espectroscopia vibratoria.datos. En todas las estructuras conocidas de las sales de aniones polihalogenados, los aniones hacen un contacto muy estrecho, a través de puentes halógenos, con los contracationes. [4] Por ejemplo, en estado sólido, [IF 6 ] - no es regularmente octaédrico, ya que la estructura de estado sólido de [Me 4 N] + [IF 6 ] - revela dímeros de [I 2 F 11 ] 2− débilmente unidos. También se encontraron interacciones significativas entre cationes y aniones en [BrF 2 ] + [SbF 6 ] - , [ClF 2 ]+ [SbF 6 ] - , [BrF 4 ] + [Sb 6 F 11 ] - . [2]
Los iones poliyoduro tienen estructuras mucho más complicadas. Los poliyoduros discretos suelen tener una secuencia lineal de átomos de yodo e iones de yoduro, y se describen en términos de asociación entre I 2 , I - e I-
3unidades, que refleja el origen del poliyoduro. En los estados sólidos, los poliyoduros pueden interactuar entre sí para formar cadenas, anillos o incluso complicadas redes bidimensionales y tridimensionales.
La unión en iones polihalogenados en su mayoría invocan el uso predominante de orbitales p. Es improbable una participación significativa del orbital d en la unión, ya que se requerirá mucha energía de promoción, mientras que se espera una participación del orbital s escasa en las especies que contienen yodo debido al efecto de par inerte , sugerido por los datos de la espectroscopía de Mössbauer . Sin embargo, ningún modelo de unión ha sido capaz de reproducir un rango tan amplio de longitudes de unión y ángulos observados hasta ahora. [3]