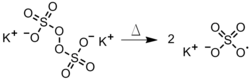polimerización radical
La polimerización por radicales libres ( FRP ) es un método de polimerización mediante el cual se forma un polímero mediante la adición sucesiva de bloques de construcción de radicales libres . Los radicales libres pueden formarse por varios mecanismos diferentes, que generalmente involucran moléculas iniciadoras separadas. Después de su generación, el radical libre iniciador agrega unidades de monómero (no radicales) , haciendo crecer así la cadena polimérica.
La polimerización por radicales libres es una ruta de síntesis clave para la obtención de una amplia variedad de diferentes polímeros y materiales compuestos . La naturaleza relativamente no específica de las interacciones químicas de radicales libres hace que esta sea una de las formas de polimerización más versátiles disponibles y permite reacciones fáciles de extremos de cadena de radicales libres poliméricos y otros productos químicos o sustratos. En 2001, 40 mil millones de los 110 mil millones de libras de polímeros producidos en los Estados Unidos fueron producidos por polimerización por radicales libres. [1]
La polimerización por radicales libres es un tipo de polimerización de crecimiento en cadena , junto con la polimerización aniónica , catiónica y de coordinación .
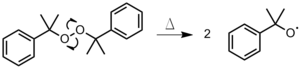
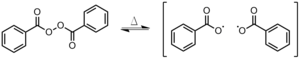
La iniciación es el primer paso del proceso de polimerización . Durante la iniciación, se crea un centro activo a partir del cual se genera una cadena polimérica. No todos los monómeros son susceptibles a todos los tipos de iniciadores. La iniciación radical funciona mejor en el doble enlace carbono-carbono de los monómeros de vinilo y el doble enlace carbono-oxígeno en aldehídos y cetonas . [1] La iniciación tiene dos pasos. En el primer paso, se crean uno o dos radicales a partir de las moléculas iniciadoras. En el segundo paso, los radicales se transfieren desde las moléculas iniciadoras a las unidades monoméricas presentes. Hay varias opciones disponibles para estos iniciadores.
Debido a las reacciones secundarias ya la síntesis ineficiente de las especies radicales, la iniciación de la cadena no es del 100% [ aclarar ] . El factor de eficiencia f se usa para describir la concentración radical efectiva. El valor máximo de f es 1, pero los valores típicos oscilan entre 0,3 y 0,8. La siguiente es una lista de reacciones que disminuyen la eficiencia del iniciador.
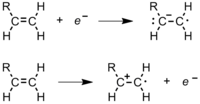
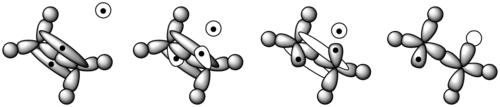
Durante la polimerización, un polímero pasa la mayor parte de su tiempo aumentando la longitud de su cadena o propagándose. Después de que se forma el iniciador radical , ataca a un monómero (Figura 11). [8] En un monómero de eteno, un par de electrones se mantiene seguro entre los dos carbonos en un enlace sigma . El otro se mantiene más suelto en un enlace pi . El radical libre usa un electrón del enlace pi para formar un enlace más estable con el átomo de carbono. El otro electrón vuelve al segundo átomo de carbono, convirtiendo toda la molécula en otro radical. Esto comienza la cadena de polímero. La figura 12 muestra cómo interactúan los orbitales de un monómero de etileno con un iniciador de radicales. [9]