Resonancia (química)
En química , la resonancia , también llamada mesomerismo , es una forma de describir la unión en ciertas moléculas o iones mediante la combinación de varias estructuras contribuyentes (o formas , [1] también conocidas como estructuras de resonancia o estructuras canónicas ) en un híbrido de resonancia (o estructura híbrida ) en la teoría del enlace de valencia . Tiene un valor particular para describir electrones deslocalizados dentro de ciertas moléculas o iones poliatómicos donde el enlace no puede expresarse por un soloestructura de lewis .
Bajo el marco de la teoría del enlace de valencia , la resonancia es una extensión de la idea de que el enlace en una especie química puede describirse mediante una estructura de Lewis. Para muchas especies químicas, una sola estructura de Lewis, que consta de átomos que obedecen la regla del octeto , posiblemente con cargas formales y conectados por enlaces de orden entero positivo, es suficiente para describir el enlace químico y racionalizar propiedades moleculares determinadas experimentalmente como longitudes de enlace , ángulos y momento dipolar . [2]Sin embargo, en algunos casos, se podría dibujar más de una estructura de Lewis y las propiedades experimentales son inconsistentes con cualquier estructura. Para abordar este tipo de situación, varias estructuras contribuyentes se consideran juntas como un promedio, y se dice que la molécula está representada por un híbrido de resonancia en el que varias estructuras de Lewis se usan colectivamente para describir su verdadera estructura.
Por ejemplo, en NO 2 – , anión nitrito , las dos longitudes de enlace N–O son iguales, aunque ninguna estructura de Lewis tiene dos enlaces N–O con el mismo orden de enlace formal . Sin embargo, su estructura medida es consistente con una descripción como un híbrido de resonancia de las dos principales estructuras contribuyentes que se muestran arriba: tiene dos enlaces N-O iguales de 125 pm, de longitud intermedia entre un enlace simple N-O típico (145 pm en hidroxilamina , H 2 N–OH) y doble enlace N–O (115 pm en ion nitronio , [O=N=O] +). De acuerdo con las estructuras contribuyentes, cada enlace N-O es un promedio de un enlace formal simple y doble formal, lo que lleva a un orden de enlace verdadero de 1.5. En virtud de este promedio, la descripción de Lewis del enlace en el NO 2 – se reconcilia con el hecho experimental de que el anión tiene enlaces N–O equivalentes.
El híbrido de resonancia representa la molécula real como el "promedio" de las estructuras contribuyentes, con longitudes de enlace y cargas parciales que toman valores intermedios en comparación con los esperados para las estructuras de Lewis individuales de los contribuyentes, si existieran como entidades químicas "reales". . [3] Las estructuras contribuyentes difieren solo en la distribución formal de electrones a los átomos, y no en la densidad real física y químicamente significativa de electrones o espín. Si bien las estructuras contribuyentes pueden diferir en los órdenes de enlace formales y en las asignaciones de carga formales , todas las estructuras contribuyentes deben tener el mismo número de electrones de valencia y la misma multiplicidad de espín . [4]
Debido a que la deslocalización de electrones reduce la energía potencial de un sistema, cualquier especie representada por un híbrido de resonancia es más estable que cualquiera de las estructuras contribuyentes (hipotéticas). [5] La diferencia de energía potencial entre la especie real y la energía (calculada) de la estructura contribuyente con la energía potencial más baja se denomina energía de resonancia [6] o energía de deslocalización. La magnitud de la energía de resonancia depende de las suposiciones hechas sobre las especies hipotéticas "no estabilizadas" y los métodos computacionales utilizados y no representa una cantidad física medible, aunque las comparaciones de energías de resonancia calculadas bajo suposiciones y condiciones similares pueden ser químicamente significativas.
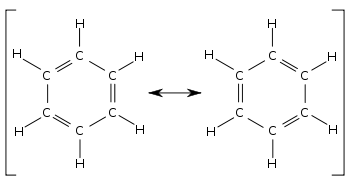
Las moléculas con un sistema π extendido, como los polienos lineales y los compuestos poliaromáticos, están bien descritas por los híbridos de resonancia, así como por los orbitales deslocalizados en la teoría de orbitales moleculares .


![{\displaystyle {\ce {[S=C=N^{\ominus }<->\ ^{\ominus }\!SC{\equiv }N]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc41b6c9b3f1ef739335969a581e9a66d5ed0b1a)

