Principio de sabatier
El principio de Sabatier es un concepto cualitativo en catálisis química heterogénea que lleva el nombre del químico francés Paul Sabatier . Establece que las interacciones entre el catalizador y el sustrato deben ser "correctas"; es decir, ni demasiado fuerte ni demasiado débil. Si la interacción es demasiado débil, la molécula no se unirá al catalizador y no se producirá ninguna reacción. Por otro lado, si la interacción es demasiado fuerte, el producto no se disocia. [1]
El principio se puede mostrar gráficamente trazando la velocidad de reacción frente a una propiedad como el calor de adsorción del reactivo por el catalizador. Estas gráficas pasan por un máximo, se parecen más o menos a un triángulo o una parábola invertida, y se denominan gráficas de volcán debido a su forma. [1] También se pueden construir gráficos tridimensionales análogos contra dos propiedades diferentes, como los calores de adsorción de los dos reactivos para una reacción de dos componentes. En ese caso, la gráfica se muestra generalmente como una gráfica de contorno y se llama superficie de volcán . [2] Las parcelas de volcanes fueron introducidas por Balandin. [3] [4]
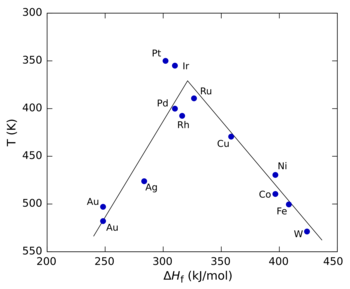
La figura de la derecha muestra un diagrama de volcán para la descomposición del ácido fórmico utilizando diferentes metales de transición como catalizadores. [5] En este caso, el calor de formación (Δ H f ) de la sal de formiato metálico se utilizó para el eje x porque los estudios mostraron que el intermedio de reacción era un formato de superficie. Para el eje y, se utilizó la temperatura a la que la reacción alcanza una velocidad específica (el eje y se traza al revés para preservar la forma convencional de "volcán"). A valores bajos de Δ H f , la reacción es lenta (en otras palabras, requiere temperaturas más altas) porque la velocidad de adsorción es lenta y limita la velocidad.. A valores altos de Δ H f , la desorción se convierte en el paso limitante de la velocidad. La tasa máxima, que se observa para los metales del grupo del platino en este caso, requiere valores intermedios de Δ H f , siendo la tasa una combinación de la tasa de adsorción y la tasa de desorción. [3]
Referencias
- ↑ a b Gadi Rothenberg (2008). Catálisis: conceptos y aplicaciones verdes . Wiley-VCH. pag. 65. ISBN 978-3-527-31824-7.
- ^ Jun Cheng; P. Hu (2008). "Utilización de la superficie del volcán tridimensional para comprender la química de sistemas multifásicos en catálisis heterogénea". Mermelada. Chem. Soc . 130 (33): 10868–10869. doi : 10.1021 / ja803555g . PMID 18651740 . CS1 maint: varios nombres: lista de autores ( enlace )
- ^ a b Helmut Knözinger; Karl Kochloefl (2005). "Catálisis heterogénea y catalizadores sólidos". Enciclopedia de química industrial de Ullmann . Wiley-VCH Verlag. doi : 10.1002 / 14356007.a05_313 . ISBN 3527306730.CS1 maint: varios nombres: lista de autores ( enlace )
- ^ Balandin, A. (1969). "Estado moderno de la teoría multiplet de catálisis heterogénea1". Adv. Catal. Rel. Subj . Avances en Catálisis. 19 : 1-210. doi : 10.1016 / S0360-0564 (08) 60029-2 . ISBN 9780120078196.
- ^ Rootsaert, WJM; Sachtler, WMH (1960). "Interacción del vapor de ácido fórmico con tungsteno". Zeitschrift für Physikalische Chemie . 26 : 16-26. doi : 10.1524 / zpch.1960.26.1_2.016 . ISSN 0942-9352 .
- Catálisis