Respirovirus murino
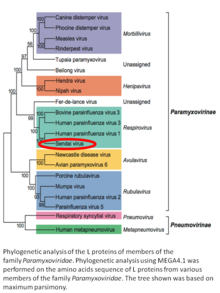
El respirovirus murino , anteriormente virus Sendai (SeV) y anteriormente también conocido como virus de la parainfluenza murina tipo 1 o virus hemaglutinante de Japón (HVJ), es un virus de ARN monocatenario envuelto , de 150-200 nm de diámetro, de sentido negativo, de la familia Paramyxoviridae . [2] [3] Por lo general, infecta a los roedores y no es patógeno para los seres humanos o los animales domésticos. El virus Sendai (SeV) es un miembro del género Respirovirus . [4] [5] El virus se aisló en la ciudad de Sendai en Japón.a principios de la década de 1950. Desde entonces, se ha utilizado activamente en la investigación como patógeno modelo. El virus es infeccioso para muchas líneas de células cancerosas (ver más abajo), tiene propiedades oncolíticas demostradas en modelos animales [6] [7] y en cánceres naturales en animales. [8] La capacidad de SeV para fusionar células eucariotas y formar sincitio se utilizó para producir células de hibridoma capaces de fabricar anticuerpos monoclonales en grandes cantidades. [9] Las aplicaciones recientes de vectores basados en SeV incluyen la reprogramación de células somáticas en células madre pluripotentes inducidas [10] [11]y creación de vacunas. Para fines de vacunación, las construcciones basadas en el virus Sendai podrían administrarse en forma de gotas nasales, que pueden ser beneficiosas para inducir una respuesta inmunitaria de la mucosa . SeV tiene varias características que son importantes en un vector para una vacuna exitosa: el virus no se integra en el genoma del huésped, no se somete a recombinación genética, se replica solo en el citoplasma sin intermediarios de ADN o una fase nuclear y no está causando cualquier enfermedad en humanos o animales domésticos. El virus Sendai se utiliza como columna vertebral para el desarrollo de vacunas contra Mycobacterium tuberculosis que causa la tuberculosis , contra el VIH-1 que causa el SIDA y contra el virus respiratorio sincitial (VSR).[12] que causa infección respiratoria en niños. El desarrollo de la vacuna contra Mycobacterium tuberculosis se encuentra en etapa preclínica, [13] contra el VIH-1 alcanzó la fase II del ensayo clínico [14] [15] y contra el VSR se encuentra en la fase I. [16] Fudan University en colaboración con ID Pharma Co. Ltd. se dedica al desarrollo de la vacuna para la prevención de COVID-19. SeV sirve como vector principal de la vacuna en el proyecto. [17]
La replicación de SeV ocurre exclusivamente en el citoplasma de la célula huésped. El virus utiliza su propia ARN polimerasa. Un ciclo de replicación dura aproximadamente de 12 a 15 horas y una célula produce miles de viriones. [18]
El virus es responsable de una infección del tracto respiratorio altamente transmisible en ratones, hámsteres, cobayas, ratas, [19] y ocasionalmente en titíes, [20] con infección que atraviesa tanto el aire como las rutas de contacto directo. La infección natural se produce a través del tracto respiratorio. En instalaciones para animales, la transmisión aérea puede ocurrir a una distancia de 5 a 6 pies, así como a través de sistemas de manejo de aire. El virus se puede detectar en colonias de ratones en todo el mundo, [21] generalmente en la lactancia de ratones adultos jóvenes. Un estudio en Francia informó anticuerpos contra SeV en el 17% de las colonias de ratones examinadas. [22] Las infecciones epizoóticas de ratones generalmente se asocian con una alta tasa de mortalidad, mientras que enzoóticaslos patrones de la enfermedad sugieren que el virus está latente y puede eliminarse en el transcurso de un año. [3] La exposición subletal al SeV puede promover una inmunidad duradera a más dosis letales de SeV. [23] El virus es inmunosupresor y puede predisponer a infecciones bacterianas secundarias. [24] No existen estudios científicos, que se realizaron utilizando métodos de detección modernos, que identificaran al SeV como causante de enfermedades infecciosas y de muerte en humanos o animales domésticos. [ cita requerida ]