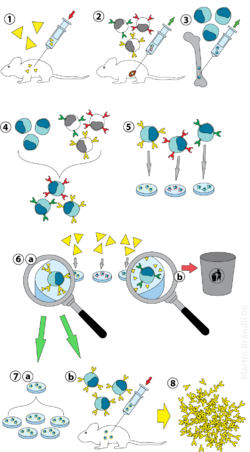
La tecnología de hibridoma es un método para producir una gran cantidad de anticuerpos idénticos (también llamados anticuerpos monoclonales ). Este proceso comienza inyectando a un ratón (u otro mamífero) un antígeno que provoca una respuesta inmune. Un tipo de glóbulo blanco, el linfocito B , produce anticuerpos que se unen al antígeno inyectado. Estas células B productoras de anticuerpos se extraen del ratón y, a su vez, se fusionan con células cancerosas de células B inmortales, un mieloma , [ aclaración necesaria ] para producir una línea celular híbrida llamada hibridoma., que tiene tanto la capacidad de producir anticuerpos de las células B como la longevidad y reproductividad del mieloma. Los hibridomas se pueden hacer crecer en cultivo, cada cultivo comenzando con una célula de hibridoma viable, produciendo cultivos cada uno de los cuales consta de hibridomas genéticamente idénticos que producen un anticuerpo por cultivo (monoclonal) en lugar de mezclas de diferentes anticuerpos (policlonal). La línea celular de mieloma que se usa en este proceso se selecciona por su capacidad para crecer en cultivo de tejidos y por la ausencia de síntesis de anticuerpos. A diferencia de los anticuerpos policlonales , que son mezclas de muchas moléculas de anticuerpos diferentes, los anticuerpos monoclonales producidos por cada línea de hibridoma son todos químicamente idénticos.
La producción de anticuerpos monoclonales fue inventada por César Milstein y Georges JF Köhler en 1975. Compartieron el Premio Nobel de Medicina y Fisiología de 1984 con Niels Kaj Jerne , quien hizo otras contribuciones a la inmunología. El término hibridoma fue acuñado por Leonard Herzenberg durante su año sabático en el laboratorio de César Milstein en 1976-1977. [1]
Método [ editar ]
Los animales de laboratorio ( mamíferos , por ejemplo, ratones) se exponen primero al antígeno contra el que se va a generar un anticuerpo. Por lo general, esto se realiza mediante una serie de inyecciones del antígeno en cuestión, en el transcurso de varias semanas. Estas inyecciones suelen ir seguidas del uso de electroporación in vivo , que mejora significativamente la respuesta inmunitaria. Una vez que los esplenocitos se aíslan a partir del mamífero bazo , las células B se fusionan con células de mieloma inmortalizadas. La fusión de las células B con células de mieloma se puede realizar mediante electrofusión. Electrofusiónhace que las células B y las células de mieloma se alineen y fusionen con la aplicación de un campo eléctrico. Alternativamente, se puede hacer que las células B y los mielomas se fusionen mediante protocolos químicos, con mayor frecuencia utilizando polietilenglicol . Las células de mieloma se seleccionan de antemano para garantizar que no secreten anticuerpos por sí mismas y que carecen del gen de hipoxantina-guanina fosforribosiltransferasa (HGPRT), lo que las hace sensibles al medio HAT (ver más abajo).
Las células fusionadas se incuban en medio HAT (medio hipoxantina - aminopterina - timidina ) durante aproximadamente 10 a 14 días. La aminopterina bloquea la vía que permite la síntesis de nucleótidos. Por lo tanto, las células de mieloma no fusionadas mueren, ya que no pueden producir nucleótidos por las vías de novo o de rescate.porque carecen de HGPRT. La eliminación de las células de mieloma no fusionadas es necesaria porque tienen el potencial de sobrepasar el crecimiento de otras células, especialmente los hibridomas débilmente establecidos. Las células B no fusionadas mueren porque tienen una vida corta. De esta forma, solo sobreviven los híbridos de células B-mieloma, ya que el gen HGPRT procedente de las células B es funcional. Estas células producen anticuerpos (una propiedad de las células B) y son inmortales (una propiedad de las células de mieloma). A continuación, el medio incubado se diluye en placas de pocillos múltiples hasta tal punto que cada pocillo contiene sólo una célula. Dado que los anticuerpos de un pocillo son producidos por la misma célula B, se dirigirán hacia el mismo epítopo y, por lo tanto, son anticuerpos monoclonales.
La siguiente etapa es un proceso de cribado primario rápido, que identifica y selecciona solo aquellos hibridomas que producen anticuerpos de la especificidad apropiada. La primera técnica de detección utilizada se llama ELISA . A continuación, se incuban el sobrenadante del cultivo de hibridoma, el conjugado marcado con enzima secundaria y el sustrato cromogénico, y la formación de un producto coloreado indica un hibridoma positivo. Alternativamente, también se puede usar el cribado inmunocitoquímico, [2] Western blot e inmunoprecipitación-espectrometría de masas. A diferencia de los ensayos de transferencia Western, la espectrometría de masas por inmunoprecipitación facilita la selección y clasificación de los clones que se unen a las formas nativas (no desnaturalizadas) de las proteínas antigénicas. [3]
La célula B que produce los anticuerpos deseados se puede clonar para producir muchos clones hijos idénticos. Los medios suplementarios que contienen interleucina-6 (como briclona ) son esenciales para este paso. Una vez que se establece una colonia de hibridomas, crecerá continuamente en un medio de cultivo como RPMI-1640 (con antibióticos y suero bovino fetal) y producirá anticuerpos. [2]
Las placas de pocillos múltiples se utilizan inicialmente para hacer crecer los hibridomas y, después de la selección, se cambian por matraces de cultivo de tejidos más grandes. Esto mantiene el bienestar de los hibridomas y proporciona suficientes células para la criopreservación y el sobrenadante para investigaciones posteriores. El sobrenadante del cultivo puede producir de 1 a 60 μg / ml de anticuerpo monoclonal, que se mantiene a -20 ° C o menos hasta que se requiera. [2]
Mediante el uso de sobrenadante de cultivo o una preparación de inmunoglobulina purificada, se puede realizar un análisis adicional de un hibridoma productor de anticuerpo monoclonal potencial en términos de reactividad, especificidad y reactividad cruzada. [2]
Aplicaciones [ editar ]
El uso de anticuerpos monoclonales es numeroso e incluye la prevención, el diagnóstico y el tratamiento de enfermedades. Por ejemplo, los anticuerpos monoclonales pueden distinguir subconjuntos de células B y células T , lo que es útil para identificar diferentes tipos de leucemias . Además, se han utilizado anticuerpos monoclonales específicos para definir marcadores de superficie celular en glóbulos blancos y otros tipos de células. Esto condujo a la agrupación de series de marcadores de diferenciación . Estos a menudo se denominan marcadores de CD y definen varios cientos de componentes diferentes de la superficie celular de las células, cada uno especificado por la unión de un anticuerpo monoclonal particular. Dichos anticuerpos son extremadamente útiles para la clasificación de células activadas por fluorescencia., el aislamiento específico de determinados tipos de células.
En histopatología diagnóstica [ editar ]
Con la ayuda de anticuerpos monoclonales, los tejidos y órganos pueden clasificarse en función de su expresión de ciertos marcadores definidos, que reflejan la génesis tisular o celular. El antígeno prostático específico , la fosfatasa alcalina placentaria , la gonadotropina coriónica humana , la α-fetoproteína y otros son antígenos asociados a órganos y la producción de anticuerpos monoclonales contra estos antígenos ayuda a determinar la naturaleza de un tumor primario. [2]
Los anticuerpos monoclonales son especialmente útiles para distinguir lesiones morfológicamente similares, como mesotelioma pleural y peritoneal , adenocarcinoma , y en la determinación del origen del órgano o tejido de metástasis indiferenciadas . Los anticuerpos monoclonales seleccionados ayudan en la detección de metástasis ocultas ( cáncer de origen primario desconocido ) mediante análisis inmunocitológico de médula ósea, otros aspirados de tejido, así como ganglios linfáticos y otros tejidos y pueden tener una mayor sensibilidad sobre la tinción histopatológica normal . [2]
Un estudio [4] realizó un ensayo inmunohistoquímico sensible en aspirados de médula ósea de 20 pacientes con cáncer de próstata localizado. En el ensayo se utilizaron tres anticuerpos monoclonales (T16, C26 y AE-1), capaces de reconocer antígenos de membrana y citoesqueléticos expresados por células epiteliales para detectar células tumorales. Aspirados de médula ósea del 22% de los pacientes con cáncer de próstata localizado (estadio B, 0/5; estadio C, 2/4) y del 36% de los pacientes con cáncer de próstata metastásico (estadio D1, 0/7 pacientes; estadio D2, 4 / 4 pacientes) tenían células positivas al antígeno en la médula ósea. Se concluyó que la tinción inmunohistoquímica de los aspirados de médula ósea es muy útil para detectar metástasis ocultas en la médula ósea en pacientes con cáncer de próstata aparentemente localizado.
Aunque la inmunocitoquímica que usa anticuerpos monoclonales asociados a tumores ha conducido a una capacidad mejorada para detectar células de cáncer de mama ocultas en aspirados de médula ósea y sangre periférica, es necesario un mayor desarrollo de este método antes de que pueda usarse de forma rutinaria. [5] Un inconveniente importante de la inmunocitoquímica es que solo se usan anticuerpos monoclonales asociados al tumor y no específicos del tumor y, como resultado, puede ocurrir alguna reacción cruzada con células normales. [6]
Para estadificar eficazmente el cáncer de mama y evaluar la eficacia de los regímenes de purga antes de la infusión de células madre autólogas, es importante detectar incluso pequeñas cantidades de células de cáncer de mama. Los métodos inmunohistoquímicos son ideales para este propósito porque son simples, sensibles y bastante específicos. Franklin y col. [7] realizó un ensayo inmunocitoquímico sensible usando una combinación de cuatro anticuerpos monoclonales (260F9, 520C9, 317G5 y BrE-3) contra las glicoproteínas de la superficie de las células tumorales para identificar las células tumorales de mama en la médula ósea y la sangre periférica. A partir de los resultados, concluyeron que la tinción inmunocitoquímica de la médula ósea y la sangre periférica es una forma sencilla y sensible de detectar y cuantificar las células del cáncer de mama.
Una de las principales razones de la recaída metastásica en pacientes con tumores sólidos es la diseminación temprana de células malignas. El uso de anticuerpos monoclonales (mAb) específicos para citoqueratinas puede identificar células tumorales epiteliales individuales diseminadas en la médula ósea.
Un estudio [8] informa sobre haber desarrollado un procedimiento inmunocitoquímico para el marcaje simultáneo del componente citoqueratina núm. 18 (CK18) y antígeno prostático específico (PSA). Esto ayudaría en la caracterización adicional de células tumorales epiteliales individuales diseminadas en pacientes con cáncer de próstata. Los doce aspirados de control de pacientes con hipertrofia prostática benigna mostraron tinción negativa, lo que respalda aún más la especificidad de CK18 en la detección de células tumorales epiteliales en la médula ósea.
En la mayoría de los casos de enfermedad maligna complicada por derrame, las células neoplásicas se pueden reconocer fácilmente. Sin embargo, en algunos casos, las células malignas no se ven tan fácilmente o su presencia es demasiado dudosa para llamarlo un informe positivo. El uso de técnicas inmunocitoquímicas aumenta la precisión diagnóstica en estos casos.
Ghosh, Mason y Spriggs [9] analizaron 53 muestras de líquido pleural o peritoneal de 41 pacientes con enfermedad maligna. El examen citológico convencional no reveló células neoplásicas. Se utilizaron tres anticuerpos monoclonales (anti-CEA, Ca 1 y HMFG-2) para buscar células malignas. El marcado inmunocitoquímico se realizó en frotis sin teñir, que se habían almacenado a -20 ° C hasta 18 meses. Doce de los cuarenta y un casos en los que se realizó tinción inmunocitoquímica revelaron células malignas. El resultado representó un aumento en la precisión del diagnóstico.de aproximadamente el 20%. El estudio concluyó que en pacientes con sospecha de enfermedad maligna, el etiquetado inmunocitoquímico debe usarse de forma rutinaria en el examen de muestras citológicamente negativas y tiene importantes implicaciones con respecto al manejo del paciente.
Otra aplicación de la tinción inmunocitoquímica es para la detección de dos antígenos en el mismo frotis. La tinción doble con anticuerpos de cadena ligera y con marcadores de células T y B puede indicar el origen neoplásico de un linfoma. [10]
Un estudio ha informado del aislamiento de una línea celular de hibridoma (clon 1E10), que produce un anticuerpo monoclonal (IgM, isotipo k). Este anticuerpo monoclonal muestra una tinción inmunocitoquímica específica de los nucléolos. [11]
Los tejidos y tumores se pueden clasificar en función de su expresión de ciertos marcadores, con la ayuda de anticuerpos monoclonales. Ayudan a distinguir lesiones morfológicamente similares y a determinar el origen orgánico o tisular de las metástasis indiferenciadas. El análisis inmunocitológico de médula ósea, aspirados de tejido, ganglios linfáticos, etc. con anticuerpos monoclonales seleccionados ayuda en la detección de metástasis ocultas. Los anticuerpos monoclonales aumentan la sensibilidad para detectar incluso pequeñas cantidades de células invasoras o metastásicas. Los anticuerpos monoclonales (mAb) específicos para citoqueratinas pueden detectar células tumorales epiteliales individuales diseminadas en la médula ósea.
Referencias [ editar ]
- ^ Milstein, C (1999). "La revolución del hibridoma: una rama de la investigación básica". BioEssays . 21 (11): 966–73. doi : 10.1002 / (SICI) 1521-1878 (199911) 21:11 <966 :: AID-BIES9> 3.0.CO; 2-Z . PMID 10517870 .
- ^ a b c d e f Nelson, PN; Reynolds, GM; Waldron, EE; Ward, E; Giannopoulos, K; Murray, PG (2000). "Desmitificado ...: Anticuerpos monoclonales" . Patología molecular . 53 (3): 111–7. doi : 10.1136 / mp.53.3.111 . PMC 1186915 . PMID 10897328 .
- ^ Korbakis, D; Brinc, D; Schiza, C; Soosaipillai, A; Jarvi, K; Drabovich, AP; Diamandis, E (2015). "El cribado de monitorización de reacciones seleccionadas por inmunocaptura facilita el desarrollo de ELISA para la medición de TEX101 nativo en fluidos biológicos" . Proteómica molecular y celular . 14 (6): 1517-1526. doi : 10.1074 / mcp.M114.047571 . PMC 4458717 . PMID 25813379 .
- ^ Bretton, PR; Melamed, MR; Regular, WR; Cote, RJ (1994). "Detección de micrometástasis ocultas en la médula ósea de pacientes con carcinoma de próstata". De próstata . 25 (2): 108-14. doi : 10.1002 / pros.2990250208 . PMID 7518596 .
- ^ Kvalheim, G (1996). "Detección de células tumorales ocultas en la médula ósea y la sangre en pacientes con cáncer de mama: métodos e importancia clínica" . Acta Oncol . 35 : 13-18. doi : 10.3109 / 02841869609098516 . PMID 9073044 .
- ^ Kvalheim, G (1998). "Diagnóstico de enfermedad residual mínima en médula ósea y sangre en pacientes con cáncer: métodos e implicaciones clínicas". Acta Oncologica . 37 (5): 455–62. doi : 10.1080 / 028418698430403 . PMID 9831374 .
- ^ Franklin, WA; Shpall, EJ; Archer, P; Johnston, CS; Garza-Williams, S; Hami, L; Amargo, MA; Bast, RC; Jones, RB (1996). "Detección inmunocitoquímica de células de cáncer de mama en médula ósea y sangre periférica de pacientes sometidos a quimioterapia de dosis alta con soporte de células madre autólogas". Tratamiento para el cáncer de mama . 41 (1): 1–13. doi : 10.1007 / BF01807031 . PMID 8932871 .
- ↑ Riesenberg, R; Oberneder, R; Kriegmair, M; Epp, M; Bitzer, U; Hofstetter, A; Braun, S; Riethmüller, G; Pantel, K (1993). "Doble tinción inmunocitoquímica de citoqueratina y antígeno prostático específico en células tumorales prostáticas individuales". Histoquímica . 99 (1): 61–6. doi : 10.1007 / BF00268022 . PMID 7682210 .
- ^ Ghosh, AK; Mason, DY; Spriggs, AI (1983). "Tinción inmunocitoquímica con anticuerpos monoclonales en derrames serosos citológicamente" negativos "de pacientes con enfermedad maligna" . J Clin Pathol . 36 (10): 1150–53. doi : 10.1136 / jcp.36.10.1150 . PMC 498493 . PMID 6194182 .
- ^ Ghosh, AK; Spriggs, IA; Taylor-Papadimitriou, J ; Mason, DY (1983). "Tinción inmunocitoquímica de células en derrames pleurales y peritoneales con panel de anticuerpos monoclonales" . J Clin Pathol . 36 (10): 1154–64. doi : 10.1136 / jcp.36.10.1154 . PMC 498494 . PMID 6194183 .
- ^ Vissers, CJ; Flohil, CC; De Jong, AA; Dinjens, WN; Bosman, FT (1996). "Un nuevo anticuerpo monoclonal para la tinción inmunocitoquímica específica de nucléolos". Acta histochemica . 98 (2): 113–21. doi : 10.1016 / S0065-1281 (96) 80028-6 . PMID 8739296 .
Enlaces externos [ editar ]
- Hibridomas en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- "Tecnología de hibridoma" . Comprensión de la serie de cáncer: el sistema inmunológico . Instituto Nacional del Cáncer . Archivado desde el original el 5 de octubre de 2014.
- "Cultivo de células de hibridoma" .