
Los diagramas de Walsh , a menudo llamados diagramas de coordenadas angulares o diagramas de correlación , son representaciones de energías de enlace orbital calculadas de una molécula frente a una coordenada de distorsión (ángulos de enlace), que se utilizan para hacer predicciones rápidas sobre las geometrías de moléculas pequeñas. [1] [2] Al trazar el cambio en los niveles de orbitales moleculares de una molécula en función del cambio geométrico, los diagramas de Walsh explican por qué las moléculas son más estables en ciertas configuraciones espaciales (por ejemplo, por qué el agua adopta una conformación doblada). [3]
Una aplicación importante de los diagramas de Walsh es explicar la regularidad en la estructura observada para moléculas relacionadas que tienen un número idéntico de electrones de valencia (p. Ej., Por qué H 2 O y H 2 S se ven similares) y explicar cómo las moléculas alteran sus geometrías a medida que su número de electrones o cambios de estado de espín . Además, los diagramas de Walsh se pueden usar para predecir distorsiones de la geometría molecular a partir del conocimiento de cómo el LUMO (Orbital molecular desocupado más bajo) afecta al HOMO (Orbital molecular ocupado más alto) cuando la molécula experimenta una perturbación geométrica.
La regla de Walsh para predecir formas de moléculas establece que una molécula adoptará la estructura que mejor proporcione la mayor estabilidad a su HOMO. Si un cambio estructural particular no perturba el HOMO, el orbital molecular ocupado más cercano gobierna la preferencia por la orientación geométrica. [4]
Historia
Los diagramas de Walsh fueron presentados por primera vez por AD Walsh , un profesor de química británico en la Universidad de Dundee , en una serie de diez artículos en un número de la Revista de la Sociedad Química. [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] Aquí, su objetivo era racionalizar las formas adoptadas por moléculas poliatómicas en el estado fundamental así como en estados excitados , aplicando las contribuciones teóricas hechas por Mulliken. Específicamente, Walsh calculó y explicó el efecto de los cambios en la forma de una molécula sobre la energía de los orbitales moleculares. Los diagramas de Walsh son una ilustración de tal dependencia, y sus conclusiones son lo que se conoce como las "reglas de Walsh". [15]
En sus publicaciones, Walsh mostró a través de múltiples ejemplos que la geometría adoptada por una molécula en su estado fundamental depende principalmente del número de sus electrones de valencia. [16] Él mismo reconoció que este concepto general no era novedoso, pero explicó que los nuevos datos disponibles para él permitieron ampliar y perfeccionar las generalizaciones anteriores. También señaló que Mulliken había intentado previamente construir un diagrama de correlación para los posibles orbitales de una molécula poliatómica en dos configuraciones nucleares diferentes, e incluso había intentado usar este diagrama para explicar formas y espectros de moléculas en su suelo y estados excitados. [17] [18] Sin embargo, Mulliken no pudo explicar las razones de las subidas y bajadas de ciertas curvas con aumentos de ángulo, por lo que Walsh afirmó que "su diagrama era empírico o se basaba en cálculos no publicados". [5]
Resumen
Walsh originalmente construyó sus diagramas trazando lo que describió como "energías de enlace orbital" versus ángulos de enlace . Lo que Walsh estaba describiendo realmente con este término no está claro; algunos creen que, de hecho, se estaba refiriendo a los potenciales de ionización , sin embargo, esto sigue siendo un tema de debate. [19] En cualquier caso, el concepto general que propuso fue que la energía total de una molécula es igual a la suma de todas las "energías de enlace orbital" en esa molécula. Por tanto, a partir del conocimiento de la estabilización o desestabilización de cada uno de los orbitales por una alteración del ángulo de enlace molecular, se puede predecir el ángulo de enlace de equilibrio para un estado particular de la molécula. Los orbitales que interactúan para estabilizar una configuración (por ejemplo, lineal) pueden superponerse o no en otra configuración (por ejemplo, doblada), por lo que una geometría será calculablemente más estable que la otra.
Por lo general, los orbitales del núcleo (1 para B, C, N, O, F y Ne) se excluyen de los diagramas de Walsh porque tienen una energía tan baja que no experimentan un cambio significativo por variaciones en el ángulo de enlace. Solo se consideran los orbitales de valencia. Sin embargo, se debe tener en cuenta que algunos de los orbitales de valencia a menudo están desocupados.
Generación de diagramas de Walsh
Al preparar un diagrama de Walsh, la geometría de una molécula debe optimizarse primero, por ejemplo, utilizando el método Hartree-Fock (HF) [2] para aproximar la función de onda del estado fundamental y la energía del estado fundamental de un sistema cuántico de muchos cuerpos. [20] A continuación, se realizan energías de un solo punto para una serie de geometrías desplazadas de la geometría de equilibrio determinada anteriormente. Las energías de un solo punto (SPEs) son cálculos de superficies de energía potencial de una molécula para una disposición específica de los átomos en esa molécula. Al realizar estos cálculos, las longitudes de los enlaces permanecen constantes (en equilibriovalores) y solo el ángulo de enlace debe modificarse de su valor de equilibrio. El cálculo de un solo punto para cada geometría se puede trazar contra el ángulo de enlace para producir el diagrama de Walsh representativo.
Estructura de un diagrama de Walsh

AH 2 Moléculas
Para el sistema molecular AH 2 más simple , Walsh produjo el primer diagrama de correlación angular trazando las curvas de energía orbital ab initio para los orbitales moleculares canónicos mientras cambiaba el ángulo de enlace de 90 ° a 180 °. A medida que se distorsiona el ángulo de enlace, la energía de cada uno de los orbitales se puede seguir a lo largo de las líneas, lo que permite una rápida aproximación de la energía molecular en función de la conformación. Todavía no está claro si la ordenada de Walsh considera o no la repulsión nuclear, y esto sigue siendo un tema de debate. [21] Un resultado de predicción típico para el agua es un ángulo de enlace de 90 °, que ni siquiera se acerca al valor derivado experimental de 104 °. En el mejor de los casos, el método puede diferenciar entre una molécula curva y una lineal. [2]
Este mismo concepto se puede aplicar a otras especies, incluidas las moléculas AB 2 y BAC no hidruro , moléculas HAB y HAAH, moléculas hidruro tetraatómico (AH 3 ), moléculas no hidruro tetraatómico (AB), moléculas H 2 AB, acetaldehído , moléculas pentaatómicas (CH3I ), moléculas hexaatómicas ( etileno ) y benceno .
Reactividad
Los diagramas de Walsh junto con la teoría de orbitales moleculares también se pueden utilizar como herramienta para predecir la reactividad. Al generar un diagrama de Walsh y luego determinar el HOMO / LUMO de esa molécula, se puede determinar cómo es probable que reaccione la molécula. En el siguiente ejemplo, se predice la acidez de Lewis de moléculas AH 3 como BH 3 y CH 3 + .
Las moléculas de AH 3 de seis electrones deben tener una conformación plana. Puede verse que el HOMO, 1e ', del AH 3 planar se desestabiliza al doblar los enlaces AH para formar una forma piramidal, debido a la rotura del enlace. El LUMO, que se concentra en un centro atómico, es un buen aceptor de electrones y explica el carácter ácido de Lewis de BH 3 y CH 3 + . [22]
Los diagramas de correlación de Walsh también se pueden utilizar para predecir los niveles relativos de energía orbital molecular . La distorsión de los átomos de hidrógeno del CH 3 + plano al CH 3 -Nu tetraédrico provoca una estabilización del orbital de enlace C-Nu, σ. [22]
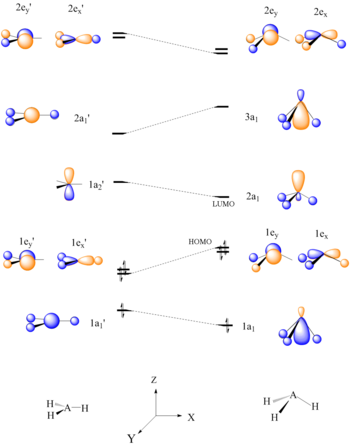 Un diagrama de Walsh para una molécula planar AH 3 |  Diagrama de interacción orbital para la adición nucleofílica de CH 3 + |
Otros diagramas de correlación
Otros diagramas de correlación son los diagramas de Tanabe-Sugano y los diagramas de Orgel .
Ver también
|
Referencias
- ^ IUPAC , Compendio de terminología química , 2ª ed. (el "Libro de oro") (1997). Versión corregida online: (2006–) " diagrama de correlación ". doi : 10.1351 / goldbook.C01348
- ↑ a b c Miller Carrie S (2015). "Diagramas de Walsh: ejercicio de química computacional de estructura y orbitales moleculares para la química física". Revista de educación química . 92 : 1040–1043. doi : 10.1021 / ed500813d .
- ^ Chen, E .; Chang, T. (1998). "Diagrama de Walsh y la combinación lineal del método orbital de enlace". Revista de Estructura Molecular: THEOCHEM . 431 (1-2): 127-136. doi : 10.1016 / S0166-1280 (97) 00432-6 .
- ^ Mulliken, RS (1955). "Estructuras de las moléculas de halógeno y la fuerza de los enlaces simples". Mermelada. Chem. Soc. 77 (4): 884–887. doi : 10.1021 / ja01609a020 .
- ↑ a b Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte I. AH 2 moléculas". J. Chem. Soc. : 2260–2266. doi : 10.1039 / JR9530002260 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte II. Moléculas AB 2 y BAC". J. Chem. Soc. : 2266–2288. doi : 10.1039 / JR9530002266 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte III. Moléculas HAB y HAAH". J. Chem. Soc. : 2288–2296. doi : 10.1039 / JR9530002288 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte IV. Moléculas de hidruro tetratómico, AH 3 ". J. Chem. Soc. : 2296–2301. doi : 10.1039 / JR9530002296 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte V. Moléculas tetratómicas, sin hidruro, AB 3 ". J. Chem. Soc. : 2301–2306. doi : 10.1039 / JR9530002301 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte VI. Moléculas H 2 AB". J. Chem. Soc. : 2306–2317. doi : 10.1039 / JR9530002306 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte VII. Una nota sobre el espectro casi ultravioleta de acetaldehído". J. Chem. Soc. : 2318–2320. doi : 10.1039 / JR9530002318 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte VIII. Moléculas pentatómicas: moléculas CH 3 I". J. Chem. Soc. : 2321–2324. doi : 10.1039 / JR9530002321 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte IX. Moléculas hexatómicas: etileno". J. Chem. Soc. : 2325–2329. doi : 10.1039 / JR9530002325 .
- ^ Walsh, AD (1953). "Los orbitales electrónicos, formas y espectros de moléculas poliatómicas. Parte X. Una nota sobre el espectro del benceno". J. Chem. Soc. : 2330–2331. doi : 10.1039 / JR9530002330 .
- ^ Mulliken, RS (1955). "Ángulos de enlace en moléculas de tipo agua y tipo amoniaco y sus derivados". Mermelada. Chem. Soc. 77 (4): 887–891. doi : 10.1021 / ja01609a021 .
- ^ Walsh, AD (1976). "Algunas notas sobre los espectros electrónicos de pequeñas moléculas poliatómicas". En t. Rev. Sci .: Phys. Chem., Ser. Dos . 3 : 301–316.
- ^ O'Leary, B .; Mallion, RB (1987). "Diagramas de Walsh y el teorema de Hellman-Feynman: un tributo al difunto profesor Charles A. Coulson, FRS (1910-1974)". Revista de Química Matemática . 1 (4): 335–344. doi : 10.1007 / BF01205066 .
- ^ Atkins, PW (1970). Mecánica cuántica molecular . Oxford, Massachusetts: Clarendon Press. ISBN 978-0-19-855129-4.
- ^ Peters, D. (1966). "Naturaleza de las energías de un electrón de la teoría orbital molecular de electrones independientes y los diagramas de Walsh". Transacciones de la Sociedad Faraday . 6 : 1353-1361.
- ^ Chen, E .; Chang, T. (1997). "Interacción orbital y el diagrama de Mulliken-Walsh para sistemas AH 2 ". Revista de la Sociedad Química de China (Taipei) . 44 : 559–565. doi : 10.1002 / jccs.199700086 .
- ^ Takahata, Y .; Parr, RG (1974). "Tres métodos para observar los diagramas de tipo Walsh, incluidas las repulsiones nucleares" . Boletín de la Sociedad Química de Japón . 47 (6): 1380-1386. doi : 10.1246 / bcsj.47.1380 .
- ^ a b Atkins, PW .; et al. (1970). Química inorgánica: Shriver y Atkins . Oxford, Reino Unido: Oxford University Press. ISBN 978-0-19-926463-6.
Enlaces externos
|