(proteína transportadora de acilo) S-maloniltransferasa
En enzimología , una [acil-proteína transportadora] S-maloniltransferasa ( EC 2.3.1.39 ) es una enzima que cataliza la reacción química
Por tanto, los dos sustratos de esta enzima son malonil-CoA y proteína portadora de acilo , mientras que sus dos productos son CoA y malonil-acil-proteína portadora. Esta enzima pertenece a la familia de las transferasas , específicamente aquellas aciltransferasas que transfieren grupos distintos de los grupos aminoacilo. Esta enzima participa en la biosíntesis de ácidos grasos .
El nombre sistemático de esta clase de enzimas es malonil-CoA: [proteína transportadora de acilo] S-maloniltransferasa. Otros nombres de uso común incluyen malonil coenzima A-acil proteína transportadora transacilasa,
Las estructuras cristalinas de FabD de E. coli [1] y Streptomyces coelicolor [2] son conocidas y proporcionan una gran comprensión del mecanismo catalítico de FabD. En E. coli , FABD involucrado principalmente en la vía de FAS. Sin embargo, en Streptomyces coelicolor , FabD está involucrado en las vías de FAS y policétido sintasa. En ambos casos, las estructuras y los sitios activos son muy similares.
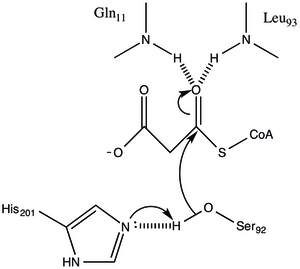
La proteína tiene una arquitectura de tipo α / β, pero el pliegue es único. el sitio activo inferido de la ubicación del catalizador Ser92 contiene un codo nucleofílico típico como se observa en las hidrolasas α / β. [1] La serina 92 tiene enlaces de hidrógeno a His 201 de una manera similar a varias hirolasas de serina. sin embargo, en lugar del ácido carboxílico que se encuentra típicamente en las tríadas catalíticas, el carbonilo de la cadena principal de Gln 250 sirve como aceptor de enlace de hidrógeno en una interacción con His 201. [1] También se encuentran otros dos residuos, Arg-117 y Glu-11. en el sitio activo, pero su función no está clara.
La ruta sintética de ácidos grasos es la ruta principal para la producción de cadenas de acilo de fosfolípidos de membrana en bacterias y plantas. [3] La secuencia de reacción se lleva a cabo mediante una serie de proteínas solubles individuales, cada una de las cuales está codificada por un gen discreto, y las vías intermedias se transportan entre las enzimas. [3] Malony-CoA: ACP Transacylasa (FabD) es una de esas proteínas solubles individuales y cataliza la siguiente reacción: