atropisómero
Los atropisómeros son estereoisómeros que surgen debido a la rotación impedida alrededor de un enlace simple , donde las diferencias de energía debidas a la tensión estérica u otros contribuyentes crean una barrera a la rotación que es lo suficientemente alta como para permitir el aislamiento de confórmeros individuales . [1] [2]
La palabra atropisómero (en griego, άτροπος, atropos , que significa "sin giro") fue acuñada en aplicación de un concepto teórico por el bioquímico alemán Richard Kuhn para el volumen seminal de la estereoquímica de Karl Freudenberg en 1933 . un bifenilo tetra sustituido , un diácido , por George Christie y James Kenner en 1922. [4] Michinori Ōki refinó aún más la definición de atropisómeros teniendo en cuenta la dependencia de la temperatura asociada con la interconversión de confórmeros, especificando que los atropisómeros se interconvierten con un medio- vidade al menos 1000 segundos a una temperatura dada, correspondiente a una barrera de energía de 93 kJ mol - 1 (22 kcal mol- 1 ) a 300 K (27 °C). [5] [6]
La estabilidad de los atropisómeros individuales es conferida por las interacciones repulsivas que inhiben la rotación. Contribuyen tanto el volumen estérico como, en principio, la longitud y la rigidez del enlace que conecta las dos subunidades. [1] [6] Comúnmente, el atropisomerismo se estudia mediante espectroscopia de resonancia magnética nuclear dinámica , ya que el atropisomerismo es una forma de fluxionalidad . [6] Las inferencias de la teoría y los resultados de las reacciones y los rendimientos también contribuyen. [7]
Los atropisómeros exhiben quiralidad axial ( quiralidad plana ). Cuando la barrera a la racemización es alta, como lo ilustran los ligandos BINAP , el fenómeno adquiere valor práctico en la síntesis asimétrica. La metacualona, el ansiolítico e hipnótico-sedante, es un ejemplo clásico de una molécula de fármaco que exhibe el fenómeno de atropisomerismo. [8]
La determinación de la estereoquímica axial de los atropisómeros de biarilo se puede lograr mediante el uso de una proyección de Newman a lo largo del eje de rotación obstaculizado. A los sustituyentes orto y, en algunos casos, meta se les asigna primero prioridad según las reglas de prioridad de Cahn-Ingold-Prelog . Un esquema de nomenclatura se basa en visualizar la helicidad definida por estos grupos. [9] Comenzando con el sustituyente de mayor prioridad en el anillo más cercano y avanzando por el camino más corto hasta el sustituyente de mayor prioridad en el otro anillo, la configuración absoluta se asigna P o Δ para el sentido de las agujas del reloj y M o Λ para el sentido contrario a las agujas del reloj. [1]Alternativamente, los cuatro grupos pueden clasificarse según las reglas de prioridad de Cahn-Ingold-Prelog, con prioridad general otorgada a los grupos en el átomo "frontal" de la proyección de Newman. Las dos configuraciones se denominan R a y S a en analogía con el R / S tradicional para un estereocentro tetraédrico tradicional. [10]
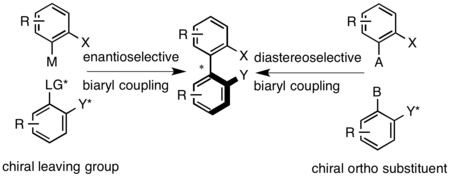
Los compuestos de biarilo axialmente quirales se preparan mediante reacciones de acoplamiento, por ejemplo, acoplamiento de Ullmann , reacción de Suzuki-Miyaura o arilación de arenos catalizada por paladio. [11] Posteriormente a la síntesis, el biarilo racémico se resuelve por métodos clásicos. El acoplamiento diastereoselectivo se puede lograr mediante el uso de un puente quiral que une los dos grupos arilo o mediante el uso de un auxiliar quiral en una de las posiciones próximas al puente axial. El acoplamiento enantioselectivo se puede lograr mediante el uso de un grupo saliente quiral en uno de los biarilos o en condiciones oxidativas que utilizan aminas quirales para establecer la configuración axial. [1]