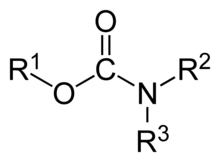
Un carbamato es una categoría de compuestos orgánicos que se deriva formalmente del ácido carbámico (NH 2 COOH). El término incluye compuestos orgánicos (por ejemplo, el éster etil carbamato ), obtenidos formalmente reemplazando uno o más de los átomos de hidrógeno por otros grupos funcionales orgánicos ; así como sales con el anión carbamato H
2NCOO-
(por ejemplo, carbamato de amonio ).
Los polímeros cuyas unidades están unidas por grupos carbamatos divalentes –NH– (C = O) –O– son una importante familia de plásticos , los poliuretanos .
Propiedades [ editar ]
Si bien los ácidos carbámicos son inestables, muchos carbamatos ( covalentes o iónicos ) son estables y bien conocidos. [ cita requerida ]
Equilibrio con carbonato y bicarbonato [ editar ]
En soluciones acuosas, el anión carbamato se equilibra lentamente con el amonio NH+
4catión y el carbonato CO2−
3o bicarbonato HCO-
3aniones: [1] [2] [3]
- H
2NCOO-
+ 2 H
2O ↔ NH+
4+ HCO-
3+ HO- - 2 H
2NCOO-
+ 2 H
2O ↔ 2 NH+
4+ 2 CO2−
3
El carbamato de calcio es soluble en agua, mientras que el carbonato de calcio no lo es. Agregar una sal de calcio a una solución de carbonato / carbamato de amonio precipitará un poco de carbonato de calcio inmediatamente y luego precipitará un poco más a medida que el carbamato se convierte. [1]
Síntesis [ editar ]
Carbamato de amonio [ editar ]
La sal de carbamato de amonio se genera mediante el tratamiento del amoníaco con dióxido de carbono : [4]
- 2 NH 3 + CO 2 → NH 4 [H 2 NCO 2 ]
Carbamatos covalentes [ editar ]
Los carbamatos también surgen a través de la alcoholisis de las cloroformamidas : [5]
- R 2 NC (O) Cl + R'OH → R 2 NCO 2 R '+ HCl
Alternativamente, los carbamatos se pueden formar a partir de cloroformiatos y aminas : [6]
- R'OC (O) Cl + R 2 NH → R 2 NCO 2 R '+ HCl
Los carbamatos pueden formarse a partir de la transposición de Curtius , donde los isocianatos formados reaccionan con un alcohol. [6]
- RCON 3 → RNCO + N 2
- RNCO + R′OH → RNHCO 2 R ′
Ocurrencia natural [ editar ]
En la naturaleza, el dióxido de carbono puede unirse con grupos amina neutrales para formar un carbamato, esta modificación postraduccional se conoce como carbamilación. [7] Se sabe que esta modificación se produce en varias proteínas importantes, véanse los ejemplos a continuación. [ cita requerida ]
Hemoglobina [ editar ]
Los grupos amino N-terminales de los residuos de valina en las cadenas α y β de la desoxihemoglobina existen como carbamatos. Ayudan a estabilizar la proteína cuando se convierte en desoxihemoglobina y aumentan la probabilidad de liberación de las moléculas de oxígeno restantes unidas a la proteína. Este efecto estabilizador no debe confundirse con el efecto Bohr (un efecto indirecto causado por el dióxido de carbono). [8]
Ureasa y fosfotriesterasa [ editar ]
Los grupos ε-amino de los residuos de lisina en ureasa y fosfotriesterasa también presentan carbamato. El carbamato derivado del aminoimidazol es un intermediario en la biosíntesis de la inosina . El carbamoil fosfato se genera a partir de carboxifosfato en lugar de CO 2 . [9]
Captura de CO 2 por la ribulosa 1,5-bisfosfato carboxilasa [ editar ]
Quizás el carbamato más importante es el que interviene en la captura de CO 2 por las plantas. Este proceso es necesario para su crecimiento. La enzima ribulosa 1,5-bisfosfato carboxilasa / oxigenasa (RuBisCO) fija una molécula de dióxido de carbono como fosfoglicerato en el ciclo de Calvin . En el sitio activo de la enzima, un ión Mg 2+ se une a los residuos de glutamato y aspartato , así como a un carbamato de lisina. El carbamato se forma cuando una cadena lateral de lisina no cargada cerca del ion reacciona con una molécula de dióxido de carbono del aire ( nola molécula de dióxido de carbono del sustrato), que luego lo hace cargado y, por lo tanto, capaz de unirse al ion Mg 2+ . [10]
Aplicaciones [ editar ]
Síntesis de urea [ editar ]
La sal carbamato de amonio se produce a gran escala como producto intermedio en la producción del producto químico básico urea a partir de amoníaco y dióxido de carbono . [11]
Plásticos de poliuretano [ editar ]
Los poliuretanos contienen múltiples grupos carbamato como parte de su estructura. El "uretano" en el nombre "poliuretano" se refiere a estos grupos carbamato; el término "enlaces de uretano" describe cómo se polimerizan los carbamatos . Por el contrario, la sustancia comúnmente llamada "uretano", el carbamato de etilo , no es un componente de los poliuretanos ni se utiliza en su fabricación. Los uretanos se forman generalmente por reacción de un alcohol con un isocianato . Comúnmente, los uretanos elaborados por una ruta sin isocianato se denominan carbamatos . [ cita requerida ]
Los polímeros de poliuretano tienen una amplia gama de propiedades y están disponibles comercialmente como espumas, elastómeros y sólidos. Normalmente, los polímeros de poliuretano se preparan combinando diisocianatos, por ejemplo, diisocianato de tolueno , y dioles , donde los grupos carbamato se forman por reacción de los alcoholes con los isocianatos :
- RN = C = O + R′OH → RNHC (O) OR ′ [ cita requerida ]
Insecticidas de carbamato [ editar ]
Los denominados insecticidas de carbamato presentan el grupo funcional éster de carbamato. Se incluyen en este grupo son aldicarb ( Temik ), carbofurano (Furadan), carbaril (Sevin), ethienocarb , fenobucarb , oxamil y metomilo . Estos insecticidas matan insectos inactivando reversiblemente la enzima acetilcolinesterasa [12] ( modo de acción 1a del IRAC ). [13] Los plaguicidas organofosforados también inhiben esta enzima, aunque de forma irreversible, y provocan una forma más grave de intoxicación colinérgica [14](el similar IRAC MoA 1b). [13]
El fenoxicarb tiene un grupo carbamato, pero actúa como un imitador de la hormona juvenil , en lugar de inactivar la acetilcolinesterasa. [15]
La icaridina repelente de insectos es un carbamato sustituido. [ cita requerida ]
Agentes carbamatos nerviosos [ editar ]
Si bien los inhibidores de carbamato acetilcolinesterasa se denominan comúnmente "insecticidas carbamato" debido a su alta selectividad para las enzimas acetilcolinesterasas de insectos en comparación con las versiones de mamíferos, los compuestos más potentes como el aldicarb y el carbofurano siguen siendo capaces de inhibir las enzimas acetilcolinesterasas de mamíferos a concentraciones suficientemente bajas. que presentan un riesgo significativo de intoxicación para los seres humanos, especialmente cuando se utilizan en grandes cantidades para aplicaciones agrícolas. Se conocen otros inhibidores de la acetilcolinesterasa basados en carbamato con una toxicidad aún mayor para los seres humanos, y algunos, como el T-1123 y el EA-3990, se investigaron para su posible uso militar como agentes nerviosos.. Sin embargo, dado que todos los compuestos de este tipo tienen un grupo amonio cuaternario con una carga positiva permanente, tienen una escasa penetración de la barrera hematoencefálica , y además solo son estables como sales cristalinas o soluciones acuosas, por lo que no se consideró que tuvieran propiedades adecuadas para armamento. [16] [17]
Conservantes y cosméticos [ editar ]
El butilcarbamato de yodopropinilo es un conservante de madera y pintura y se utiliza en cosmética. [18]
Investigación química [ editar ]
Algunos de los grupos protectores de amina más comunes, como BOC , FMOC , Cbz y troc, son carbamatos. [ cita requerida ]
Medicina [ editar ]
Carbamato de etilo [ editar ]
El uretano ( carbamato de etilo ) se produjo una vez comercialmente en los Estados Unidos como agente de quimioterapia y con otros fines medicinales. Se encontró que era tóxico y en gran medida ineficaz. [19] Ocasionalmente se utiliza como medicamento veterinario. [ cita requerida ]
Drogas carbamato [ editar ]
Además, algunos carbamatos se utilizan en la farmacoterapia humana , por ejemplo, los inhibidores de la acetilcolinesterasa neostigmina y rivastigmina , cuya estructura química se basa en el alcaloide natural fisostigmina . Otros ejemplos son el meprobamato y sus derivados como carisoprodol , felbamato , mebutamato y tybamato , una clase de ansiolíticos y relajantes musculares ampliamente utilizados en la década de 1960 antes del surgimiento de las benzodiazepinas, y que todavía se utilizan hoy en día en algunos casos. Carbacolse utiliza principalmente para diversos fines oftálmicos. [20]
El inhibidor de la proteasa darunavir para el tratamiento del VIH también contiene un grupo funcional carbamato. [21]
Toxicidad [ editar ]
Además de inhibir la acetilcolinesterasa humana [22] (aunque en menor grado que la enzima de insectos), los insecticidas de carbamato también se dirigen a los receptores de melatonina humana. [23]
Análogos de azufre [ editar ]
Hay dos átomos de oxígeno en un carbamato ( 1 ), ROC (= O) NR 2 , y uno o ambos pueden ser reemplazados conceptualmente por azufre . Los análogos de carbamatos con solo uno de los oxígenos reemplazado por azufre se denominan tiocarbamatos ( 2 y 3 ). Los carbamatos con ambos oxígenos reemplazados por azufre se denominan ditiocarbamatos ( 4 ), RSC (= S) NR 2 . [ cita requerida ]
Hay dos tipos diferentes de tiocarbamato estructuralmente isoméricos :
- O- tiocarbamatos ( 2 ), ROC (= S) NR 2 , donde el grupo carbonilo (C = O) se reemplaza con un grupo tiocarbonilo (C = S) [ cita requerida ]
- S -tiocarbamatos ( 3 ), RSC (= O) NR 2 , donde el grupo R – O– se reemplaza con un grupo R – S– [ cita requerida ]
Los O- tiocarbamatos pueden isomerizarse a S- tiocarbamatos, por ejemplo en la transposición de Newman-Kwart . [ cita requerida ]
Ver también [ editar ]
- Carbamato de metilo
- Carbamato de etilo
- Poliuretano
- Inhibidor de la colinesterasa
Referencias [ editar ]
- ↑ a b Burrows, George H .; Lewis, Gilbert N. (1912). "El equilibrio entre carbonato de amonio y carbamato de amonio en solución acuosa a 25º" . Revista de la Sociedad Química Estadounidense . 34 (8): 993–995. doi : 10.1021 / ja02209a003 .
- ^ Clark, KG; Gaddy, VL; Rist, CE (1933). "Equilibrios en el sistema de agua-urea-carbamato de amonio". Ind. Eng. Chem . 25 (10): 1092–1096. doi : 10.1021 / ie50286a008 .
- ^ Mani, Fabrizio; Peruzzini, Maurizio; Stoppioni, Piero (2006). "Absorción de CO2 por NH acuoso
3 soluciones: especiación de carbamato de amonio, bicarbonato y carbonato por un 13
C NMR study ". Green Chemistry . Royal Society of Chemistry (RSC). 8 (11): 995. doi : 10.1039 / b602051h . ISSN 1463-9262 . - ^ Brooks, LA; Audrieta, LF; Bluestone, H .; Jofinsox, WC (1946). Carbamato de amonio . Inorg. Synth . Síntesis inorgánica. 2 . págs. 85–86. doi : 10.1002 / 9780470132333.ch23 . ISBN 9780470132333.
- ^ Alizadeh, Babak Heidary; SUGIYAMA, Takeyoshi; ORITANI, Takayuki; KUWAHARA, Shigefumi (2002). "Preparación de carbamatos de arilo y alquilo sustituidos en N y su efecto inhibidor sobre la germinación de semillas de avena". Biociencia, Biotecnología y Bioquímica . Prensa de la Universidad de Oxford (OUP). 66 (2): 422–425. doi : 10.1271 / bbb.66.422 . ISSN 0916-8451 .
- ↑ a b Chaturvedi, Devdutt (1 de mayo de 2011). "Desarrollos recientes sobre la carbamación de aminas". Química Orgánica Actual . Bentham Science Publishers Ltd. 15 (10): 1593-1624. doi : 10.2174 / 138527211795378173 . ISSN 1385-2728 .
- ^ Linthwaite, Victoria L .; Janus, Joanna M .; Brown, Adrian P .; Wong-Pascua, David; O'Donoghue, AnnMarie C .; Porter, Andrew; Treumann, Achim; Hodgson, David RW; Cann, Martin J. (6 de agosto de 2018). "La identificación de modificaciones postraduccionales de proteínas mediadas por dióxido de carbono" . Comunicaciones de la naturaleza . 9 (1): 3092. Bibcode : 2018NatCo ... 9.3092L . doi : 10.1038 / s41467-018-05475-z . ISSN 2041-1723 . PMC 6078960 . PMID 30082797 .
- ^ Ferguson, JKW; Roughton, FJW (14 de diciembre de 1934). "La estimación química directa de compuestos carbamino de CO2 con hemoglobina" . La revista de fisiología . 83 (1): 68–86. doi : 10.1113 / jphysiol.1934.sp003212 . ISSN 0022-3751 . PMC 1394306 . PMID 16994615 .
- ^ Bartoschek, S .; Vorholt, JA; Thauer, RK; Geierstanger, BH; Griesinger, C. (2001). " Formación de N -carboximetanofurano (carbamato) a partir de metanofurano y CO 2 en arqueas metanogénicas: termodinámica y cinética de la reacción espontánea". EUR. J. Biochem . 267 (11): 3130–3138. doi : 10.1046 / j.1432-1327.2000.01331.x . PMID 10824097 .
- ^ T, Lundqvist; G, Schneider (29 de enero de 1991). "Estructura cristalina del complejo ternario de ribulosa-1,5-bisfosfato carboxilasa, Mg (II) y activador de CO2 a una resolución de 2,3-A". Bioquímica . 30 (4): 904–8. doi : 10.1021 / bi00218a004 . PMID 1899197 .
- ^ Krase, NW; Gaddy, VL (1 de julio de 1922). "Síntesis de urea a partir de amoníaco y dióxido de carbono". Revista de Química Industrial e Ingeniería . Sociedad Química Estadounidense (ACS). 14 (7): 611–615. doi : 10.1021 / ie50151a009 . ISSN 0095-9014 .
- ^ Fukuto, TR (1990). "Mecanismo de acción de los insecticidas organofosforados y carbamatos" . Perspectivas de salud ambiental . 87 : 245-254. doi : 10.1289 / ehp.9087245 . PMC 1567830 . PMID 2176588 .
- ^ a b "Esquema de clasificación del modo de acción del IRAC, versión 9.4" . IRAC ( Comité de Acción de Resistencia a Insecticidas ) (pdf). Marzo de 2020.
- ^ Metcalf, Robert L. "Control de insectos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a14_263 .
- ^ "Proyecto de información sobre plaguicidas: Fenoxicarb" . Universidad de Cornell . Consultado el 15 de junio de 2019 .
- ^ Gupta, Ramesh C (ed.) (2015). Manual de toxicología de agentes de guerra química . Cambridge, Massachusetts, Estados Unidos: Academic Press. págs. 338–339. ISBN 9780128004944.CS1 maint: texto adicional: lista de autores ( enlace )
- ^ Ellison, D (2008). Manual de agentes de guerra química y biológica . Boca Ratón: CRC Press. ISBN 978-0-8493-1434-6. OCLC 82473582 .
- ^ Badreshia, S. (2002). "Butilcarbamato de yodopropinilo". Soy. J. Dermatitis de contacto . 13 (2): 77–79. doi : 10.1053 / ajcd.2002.30728 . ISSN 1046-199X . PMID 12022126 .
- ^ Holanda, JR; Hosley, H .; Scharlau, C .; Carbone, PP; Frei, E., III; Brindley, CO; Hall, TC; Shnider, BI; Gold, GL; Lasaña, L .; Owens, AH, Jr; Miller, SP (1 de marzo de 1966). "Un ensayo controlado de tratamiento con uretano en mieloma múltiple" . Sangre . 27 (3): 328–42. doi : 10.1182 / sangre.V27.3.328.328 . ISSN 0006-4971 . PMID 5933438 .
- ^ Información al consumidor de Carbachol Multum . Consultado el 27 de abril de 2021.
- ^ DrugBank DB01264 . Consultado el 27 de abril de 2021.
- ^ Colović, MB; Krstić, DZ; Lazarević-Pašti, TD; Bondzic, AM; Vasić, VM (2013). "Inhibidores de la acetilcolinesterasa: farmacología y toxicología" . Curr Neuropharmacol . 11 (3): 315–35. doi : 10.2174 / 1570159X11311030006 . PMC 3648782 . PMID 24179466 .
- ↑ Popovska-Gorevski, M; Dubocovich, ML; Rajnarayanan, RV (2017). "Los insecticidas de carbamato se dirigen a los receptores de melatonina humanos" . Chem Res Toxicol . 30 (2): 574–582. doi : 10.1021 / acs.chemrestox.6b00301 . PMC 5318275 . PMID 28027439 .