Un éster es un compuesto químico derivado de un ácido (orgánico o inorgánico) en el que al menos un grupo -OH hidroxilo se reemplaza por un grupo -O- alquilo ( alcoxi ), [1] como en la reacción de sustitución de un ácido carboxílico y un alcohol . Los glicéridos son ésteres de ácidos grasos de glicerol ; son importantes en biología, ya que son una de las principales clases de lípidos y comprenden la mayor parte de grasas animales y aceites vegetales.
Los ésteres suelen tener un olor dulce; los de bajo peso molecular se utilizan comúnmente como fragancias y se encuentran en aceites esenciales y feromonas . Actúan como disolventes de alta calidad para una amplia gama de plásticos, plastificantes , resinas y lacas , [2] y son una de las clases más grandes de lubricantes sintéticos en el mercado comercial. [3] Los poliésteres son plásticos importantes , con monómeros unidos por restos éster . Los fosfoésteres forman la columna vertebral de las moléculas de ADN . Ésteres de nitrato , comonitroglicerina , son conocidas por sus propiedades explosivas.
Nomenclatura [ editar ]
Etimología [ editar ]
La palabra éster fue acuñada en 1848 por un químico alemán Leopold Gmelin , [4] probablemente como una contracción del alemán Essigäther , " éter acético ".
Nomenclatura IUPAC [ editar ]
Los nombres de los ésteres se derivan del alcohol original y del ácido original, donde este último puede ser orgánico o inorgánico. Los ésteres derivados de los ácidos carboxílicos más simples se denominan comúnmente de acuerdo con los denominados " nombres triviales " más tradicionales, por ejemplo, formato, acetato, propionato y butirato, en oposición a la nomenclatura IUPAC metanoato, etanoato, propanoato y butanoato. Los ésteres derivados de ácidos carboxílicos más complejos, por otro lado, se nombran con más frecuencia usando el nombre sistemático IUPAC, basado en el nombre del ácido seguido del sufijo -oato . Por ejemplo, el éster hexil octanoato, también conocido con el nombre trivial de caprilato de hexilo , tiene la fórmula CH 3 (CH 2 ) 6CO 2 (CH 2 ) 5 CH 3 .
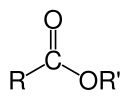
Las fórmulas químicas de los ésteres orgánicos suelen adoptar la forma RCO 2 R ', donde R y R' son las partes hidrocarbonadas del ácido carboxílico y el alcohol, respectivamente. Por ejemplo, el acetato de butilo (sistemáticamente butil etanoato), derivado de butanol y ácido acético (sistemáticamente ácido etanoico) se escribiría CH 3 CO 2 C 4 H 9 . Las presentaciones alternativas son comunes, incluyendo BuOAc y CH 3 COOC 4 H 9 .
Los ésteres cíclicos se denominan lactonas , independientemente de si se derivan de un ácido orgánico o inorgánico. Un ejemplo de una lactona orgánica es la γ-valerolactona .
Ortoésteres [ editar ]
Una clase poco común de ésteres orgánicos son los ortoésteres , que tienen la fórmula RC (OR ′) 3 . El ortoformiato de trietilo (HC (OC 2 H 5 ) 3 ) se deriva, en términos de su nombre (pero no de su síntesis), del ácido ortofórmico (HC (OH) 3 ) y el etanol .
Ésteres inorgánicos [ editar ]
Los ésteres también se pueden derivar de ácidos inorgánicos.
- El ácido fosfórico forma ésteres de fosfato , por ejemplo, trifenilfosfato
- El ácido sulfúrico forma ésteres de sulfato , por ejemplo, dimetilsulfato
- El ácido nítrico forma ésteres de nitrato , por ejemplo, nitrato de metilo.
- el ácido bórico forma boratos , por ejemplo, borato de trimetilo .
- El ácido carbónico forma ésteres de carbonato , por ejemplo, carbonato de etileno.
Los ácidos inorgánicos que existen como tautómeros forman diversos ésteres
- El ácido fosforoso forma dos tipos de ésteres de fosfito , por ejemplo, trietilfosfito (P (OEt) 3 ) y dietilfosfito (HP (O) (OEt) 2 ).
Los ácidos inorgánicos que son inestables o elusivos forman ésteres estables.
- El ácido crómico , que nunca se ha detectado, forma cromato de di-terc-butilo.
- ácido sulfuroso , que es raro, forma dimetilsulfito
En principio, todos los alcóxidos metálicos y metaloides , de los que se conocen muchos cientos, podrían clasificarse como ésteres de los ácidos hipotéticos.
Estructura y vinculación [ editar ]
Los ésteres contienen un centro carbonilo , que da lugar a ángulos de 120 ° C – C – O y O – C – O. A diferencia de las amidas , los ésteres son grupos funcionales estructuralmente flexibles porque la rotación alrededor de los enlaces C – O – C tiene una barrera baja. Su flexibilidad y baja polaridad se manifiesta en sus propiedades físicas; tienden a ser menos rígidas (punto de fusión más bajo) y más volátiles (punto de ebullición más bajo) que las amidas correspondientes . [5] El p K a de los hidrógenos alfa en los ésteres es de alrededor de 25. [6]
Muchos ésteres tienen el potencial de isomería conformacional , pero tienden a adoptar una conformación s -cis (o Z) en lugar de la alternativa s -trans (o E), debido a una combinación de efectos de hiperconjugación y minimización de dipolos . La preferencia por la conformación Z está influenciada por la naturaleza de los sustituyentes y el disolvente, si está presente. [7] [8] Las lactonas con anillos pequeños están restringidas a la conformación s -trans (es decir, E) debido a su estructura cíclica.
Propiedades físicas y caracterización [ editar ]
Los ésteres son más polares que los éteres pero menos polares que los alcoholes. Participan en enlaces de hidrógeno como aceptores de enlaces de hidrógeno, pero no pueden actuar como donantes de enlaces de hidrógeno, a diferencia de sus alcoholes parentales. Esta capacidad de participar en la formación de puentes de hidrógeno confiere cierta solubilidad en agua. Debido a su falta de capacidad para donar enlaces de hidrógeno, los ésteres no se autoasocian. En consecuencia, los ésteres son más volátiles que los ácidos carboxílicos de peso molecular similar. [5]
Caracterización y análisis [ editar ]
Los ésteres generalmente se identifican mediante cromatografía de gases, aprovechando su volatilidad. Los espectros de IR para los ésteres cuentan con una banda nítida intensa en el intervalo de 1730-1750 cm -1 asignados a nu C = O . Este pico cambia dependiendo de los grupos funcionales unidos al carbonilo. Por ejemplo, un anillo de benceno o un doble enlace en conjugación con el carbonilo reducirá el número de onda unos 30 cm -1 .
Aplicaciones y ocurrencia [ editar ]
Los ésteres son de naturaleza generalizada y se utilizan ampliamente en la industria. En la naturaleza, las grasas son en general triésteres derivados del glicerol y los ácidos grasos . [10] Los ésteres son responsables del aroma de muchas frutas, incluidas las manzanas , los durianos , las peras , los plátanos , las piñas y las fresas . [11] Anualmente se producen industrialmente varios miles de millones de kilogramos de poliésteres, siendo productos importantes el tereftalato de polietileno , los ésteres de acrilato y el acetato de celulosa . [12]
- Triglicérido representativo que se encuentra en un aceite de linaza, un triéster ( triglicérido ) derivado del ácido linoleico , ácido alfa-linolénico y ácido oleico .
Preparación [ editar ]
La esterificación es el nombre general de una reacción química en la que dos reactivos (típicamente un alcohol y un ácido) forman un éster como producto de reacción . Los ésteres son comunes en la química orgánica y los materiales biológicos y, a menudo, tienen un olor afrutado característico agradable. Esto conduce a su uso extensivo en la industria de las fragancias y los aromas . Los enlaces éster también se encuentran en muchos polímeros .
Esterificación de ácidos carboxílicos con alcoholes [ editar ]
La síntesis clásica es la esterificación de Fischer , que consiste en tratar un ácido carboxílico con un alcohol en presencia de un agente deshidratante :
- RCO 2 H + R′OH ⇌ RCO 2 R ′ + H 2 O
La constante de equilibrio para tales reacciones es aproximadamente 5 para ésteres típicos, por ejemplo, acetato de etilo. [13] La reacción es lenta en ausencia de un catalizador. El ácido sulfúrico es un catalizador típico de esta reacción. También se utilizan muchos otros ácidos, como los ácidos sulfónicos poliméricos . Dado que la esterificación es altamente reversible, el rendimiento del éster se puede mejorar utilizando el principio de Le Chatelier :
- Usar el alcohol en gran exceso (es decir, como disolvente).
- Uso de un agente deshidratante: el ácido sulfúrico no solo cataliza la reacción sino que secuestra el agua (un producto de reacción). También son eficaces otros agentes secantes, como los tamices moleculares .
- Eliminación de agua por medios físicos como la destilación como azeótropos de bajo punto de ebullición con tolueno , junto con un aparato Dean-Stark .
Se conocen reactivos que impulsan la deshidratación de mezclas de alcoholes y ácidos carboxílicos. Un ejemplo es la esterificación de Steglich , que es un método para formar ésteres en condiciones suaves. El método es popular en la síntesis de péptidos , donde los sustratos son sensibles a condiciones severas como altas temperaturas. Se usa DCC ( diciclohexilcarbodiimida ) para activar el ácido carboxílico para que siga reaccionando. La 4-dimetilaminopiridina (DMAP) se utiliza como catalizador de transferencia de acilo . [14]
Otro método para la deshidratación de mezclas de alcoholes y ácidos carboxílicos es la reacción de Mitsunobu :
- RCO 2 H + R′OH + P (C 6 H 5 ) 3 + R 2 N 2 → RCO 2 R ′ + OP (C 6 H 5 ) 3 + R 2 N 2 H 2
Los ácidos carboxílicos se pueden esterificar con diazometano :
- RCO 2 H + CH 2 N 2 → RCO 2 CH 3 + N 2
Usando este diazometano, se pueden convertir mezclas de ácidos carboxílicos en sus ésteres metílicos con rendimientos casi cuantitativos, por ejemplo, para análisis por cromatografía de gases . El método es útil en operaciones sintéticas orgánicas especializadas, pero se considera demasiado peligroso y costoso para aplicaciones a gran escala.
Esterificación de ácidos carboxílicos con epóxidos [ editar ]
Los ácidos carboxílicos se esterifican mediante tratamiento con epóxidos, dando β-hidroxiésteres:
- RCO 2 H + RCHCH 2 O → RCO 2 CH 2 CH (OH) R
Esta reacción se emplea en la producción de resinas de resina de éster vinílico a partir de ácido acrílico .
Alcoholisis de cloruros de acilo y anhídridos de ácido [ editar ]
Los alcoholes reaccionan con cloruros de acilo y anhídridos de ácido para dar ésteres:
- RCOCl + R′OH → RCO 2 R ′ + HCl
- (RCO) 2 O + R′OH → RCO 2 R ′ + RCO 2 H
Las reacciones son irreversibles, lo que simplifica el trabajo . Dado que los cloruros de acilo y los anhídridos de ácido también reaccionan con el agua, se prefieren las condiciones anhidras. Las acilaciones análogas de las aminas para dar amidas son menos sensibles porque las aminas son nucleófilos más fuertes y reaccionan más rápidamente que el agua. Este método se emplea solo para procedimientos a escala de laboratorio, ya que es caro.
Alquilación de sales de carboxilato [ editar ]
Aunque no se emplean ampliamente para esterificaciones, las sales de aniones carboxilato pueden ser agentes alquilantes con haluros de alquilo para dar ésteres. [12] En el caso de que se utilice un cloruro de alquilo , una sal de yoduro puede catalizar la reacción ( reacción de Finkelstein ). La sal carboxilato a menudo se genera in situ . [15] En casos difíciles, se puede utilizar el carboxilato de plata, ya que el ión de plata se coordina con el haluro ayudando a su salida y mejorando la velocidad de reacción. Esta reacción puede sufrir problemas de disponibilidad de aniones y, por tanto, puede beneficiarse de la adición de catalizadores de transferencia de fase o disolventes apróticos altamente polares comoDMF .
Transesterificación [ editar ]
La transesterificación , que implica cambiar un éster por otro, se practica ampliamente:
- RCO 2 R ′ + CH 3 OH → RCO 2 CH 3 + R′OH
Al igual que la hidrolización, la transesterificación está catalizada por ácidos y bases. La reacción se usa ampliamente para degradar triglicéridos , por ejemplo, en la producción de ésteres de ácidos grasos y alcoholes. El poli (tereftalato de etileno) se produce mediante la transesterificación de tereftalato de dimetilo y etilenglicol: [12]
- (C 6 H 4 ) (CO 2 CH 3 ) 2 + 2 C 2 H 4 (OH) 2 → 1 ⁄ n {(C 6 H 4 ) (CO 2 ) 2 (C 2 H 4 )} n + 2 CH 3 OH
Un subconjunto de la transesterificación es la alcoholisis del diceteno . Esta reacción produce 2-cetoésteres. [12]
- (CH 2 CO) 2 + ROH → CH 3 C (O) CH 2 CO 2 R
Carbonilación [ editar ]
Los alquenos experimentan una " hidroesterificación " en presencia de catalizadores de carbonilo metálico . Los ésteres de ácido propanoico se producen comercialmente mediante este método:
- C 2 H 4 + ROH + CO → C 2 H 5 CO 2 R
Una preparación de propionato de metilo es un ejemplo ilustrativo.
- C 2 H 4 + CO + MeOH → MeO 2 CCH 2 CH 3
La carbonilación del metanol produce formiato de metilo , que es la principal fuente comercial de ácido fórmico . La reacción es catalizada por metóxido de sodio :
- CH 3 OH + CO → CH 3 O 2 CH
Adición de ácidos carboxílicos a alquenos y alquinos [ editar ]
En presencia de catalizadores a base de paladio , el etileno, el ácido acético y el oxígeno reaccionan para dar acetato de vinilo :
- C 2 H 4 + CH 3 CO 2 H + 1 ⁄ 2 O 2 → C 2 H 3 O 2 CCH 3 + H 2 O
Las rutas directas a este mismo éster no son posibles porque el alcohol vinílico es inestable.
Los ácidos carboxílicos también se agregan a través de alquinos para dar los mismos productos.
El ácido silicotúngstico se utiliza para fabricar acetato de etilo mediante la alquilación de ácido acético con etileno:
- C 2 H 4 + CH 3 CO 2 H → CH 3 CO 2 C 2 H 5
De aldehídos [ editar ]
La reacción de Tishchenko implica la desproporción de un aldehído en presencia de una base anhidra para dar un éster. Los catalizadores son alcóxidos de aluminio o alcóxidos de sodio. El benzaldehído reacciona con el bencilóxido de sodio (generado a partir de sodio y alcohol bencílico ) para generar benzoato de bencilo . [16] El método se utiliza en la producción de acetato de etilo a partir de acetaldehído . [12]
Otros métodos [ editar ]
- Reordenamiento de Favorskii de α-halocetonas en presencia de base
- Oxidación de Baeyer-Villiger de cetonas con peróxidos
- Reacción de Pinner de nitrilos con un alcohol
- Abstracción nucleofílica de un complejo metal-acilo
- Hidrólisis de ortoésteres en ácido acuoso
- Celulólisis por esterificación [17]
- Ozonólisis de alquenos mediante elaboración en presencia de ácido clorhídrico y diversos alcoholes . [18]
- Oxidación anódica de metil cetonas que conduce a ésteres metílicos. [19]
- La interesterificación intercambia los grupos de ácidos grasos de diferentes ésteres.
Reacciones [ editar ]
Los ésteres reaccionan con nucleófilos en el carbono del carbonilo. El carbonilo es débilmente electrófilo pero es atacado por nucleófilos fuertes (aminas, alcóxidos, fuentes de hidruros, compuestos de organolitio, etc.). Los enlaces C-H adyacentes al carbonilo son débilmente ácidos pero sufren desprotonación con bases fuertes. Este proceso es el que suele iniciar reacciones de condensación. El oxígeno del carbonilo en los ésteres es débilmente básico, menos que el oxígeno del carbonilo en las amidas debido a la donación por resonancia de un par de electrones del nitrógeno en las amidas, pero forma aductos .
Hidrólisis y saponificación [ editar ]
La esterificación es una reacción reversible. Los ésteres se someten a hidrólisis en condiciones ácidas y básicas. En condiciones ácidas, la reacción es la reacción inversa de la esterificación de Fischer . En condiciones básicas, el hidróxido actúa como nucleófilo, mientras que un alcóxido es el grupo saliente. Esta reacción, la saponificación , es la base de la fabricación de jabón.
El grupo alcóxido también puede ser desplazado por nucleófilos más fuertes como amoníaco o aminas primarias o secundarias para dar amidas : (reacción de amonólisis)
- RCO 2 R ′ + NH 2 R ″ → RCONHR ″ + R′OH
Esta reacción no suele ser reversible. Se pueden usar hidrazinas e hidroxilamina en lugar de aminas. Los ésteres se pueden convertir en isocianatos a través de ácidos hidroxámicos intermedios en la transposición de Lossen .
Las fuentes de nucleófilos de carbono, por ejemplo, reactivos de Grignard y compuestos de organolitio, se agregan fácilmente al carbonilo.
Reducción [ editar ]
En comparación con las cetonas y los aldehídos, los ésteres son relativamente resistentes a la reducción . La introducción de la hidrogenación catalítica a principios del siglo XX fue un gran avance; los ésteres de ácidos grasos se hidrogenan a alcoholes grasos .
- RCO 2 R ′ + 2 H 2 → RCH 2 OH + R′OH
Un catalizador típico es la cromita de cobre . Antes del desarrollo de la hidrogenación catalítica , los ésteres se redujeron a gran escala mediante la reducción de Bouveault-Blanc . Este método, que es en gran parte obsoleto, utiliza sodio en presencia de fuentes de protones.
Especialmente para síntesis química fina, el hidruro de litio y aluminio se usa para reducir los ésteres a dos alcoholes primarios. El borohidruro de sodio reactivo relacionado es lento en esta reacción. DIBAH reduce los ésteres a aldehídos. [20]
La reducción directa para dar el éter correspondiente es difícil ya que el hemiacetal intermedio tiende a descomponerse para dar un alcohol y un aldehído (que se reduce rápidamente para dar un segundo alcohol). La reacción se puede lograr usando trietilsilano con una variedad de ácidos de Lewis. [21] [22]
[ editar ]
En cuanto a los aldehídos , los átomos de hidrógeno en el carbono adyacente ("a") al grupo carboxilo en los ésteres son suficientemente ácidos para sufrir desprotonación, lo que a su vez conduce a una variedad de reacciones útiles. La desprotonación requiere bases relativamente fuertes, como los alcóxidos . La desprotonación da un enolato nucleofílico , que puede reaccionar más, por ejemplo, la condensación de Claisen y su equivalente intramolecular, la condensación de Dieckmann . Esta conversión se aprovecha en la síntesis de éster malónico , en la que el diéster de ácido malónico reacciona con un electrófilo (p. Ej., Haluro de alquilo), y posteriormente se descarboxila. Otra variación es la alquilación de Fráter-Seebach .
Otras reacciones [ editar ]
- Los ésteres de fenilo reaccionan con hidroxiarilcetonas en el reordenamiento de Fries .
- Los ésteres específicos se funcionalizan con un grupo α-hidroxilo en la transposición de Chan .
- Los ésteres con átomos de β-hidrógeno se pueden convertir en alquenos en la pirólisis de ésteres .
- Conversión directa de ésteres en nitrilos . [23]
Protección de grupos [ editar ]
Como clase, los ésteres sirven como grupos protectores para los ácidos carboxílicos . La protección de un ácido carboxílico es útil en la síntesis de péptidos, para prevenir las auto-reacciones de los aminoácidos bifuncionales . Los ésteres metílicos y etílicos están comúnmente disponibles para muchos aminoácidos; el t- butil éster tiende a ser más caro. Sin embargo, los t -butilésteres son particularmente útiles porque, en condiciones fuertemente ácidas, los t -butilésteres se eliminan para dar el ácido carboxílico y el isobutileno , lo que simplifica el tratamiento.
Lista de olores de éster [ editar ]
Muchos ésteres tienen olores característicos a frutas y muchos se encuentran naturalmente en los aceites esenciales de las plantas. Esto también ha llevado a su uso común en aromas y fragancias artificiales que tienen como objetivo imitar esos olores.
| Nombre de éster | Estructura | Olor u ocurrencia |
|---|---|---|
| Hexanoato de alilo | piña | |
| Acetato de bencilo | pera , fresa , jazmín | |
| Acetato de bornilo | pino | |
| Acetato de butilo | manzana , miel | |
| Butirato de butilo | piña | |
| Propanoato de butilo | gotas de pera | |
| Acetato de etilo | removedor de esmalte de uñas , modelo pintura , modelo de avión de pegamento | |
| Benzoato de etilo | dulce , gaulteria , afrutado , medicinal, cereza , uva | |
| Butirato de etilo | plátano , piña , fresa | |
| Hexanoato de etilo | piña , plátano verde ceroso | |
| Cinamato de etilo | canela | |
| Etanoato de etilo | peras | |
| Formiato de etilo | limón , ron , fresa | |
| Heptanoato de etilo | albaricoque , cereza , uva , frambuesa | |
| Isovalerato de etilo | manzana | |
| Lactato de etilo | mantequilla , nata | |
| Nonanoato de etilo | uva | |
| Pentanoato de etilo | manzana | |
| Acetato de geranilo | geranio | |
| Butirato de geranilo | cereza | |
| Pentanoato de geranilo | manzana | |
| Acetato de isobutilo | cereza , frambuesa , fresa | |
| Formiato de isobutilo | frambuesa | |
| Acetato de isoamilo | pera , plátano (aromatizante en gotas de pera ) | |
| Acetato de isopropilo | sabroso | |
| Acetato de linalilo | lavanda , salvia | |
| Butirato de linalilo | Durazno | |
| Formiato de linalilo | manzana , melocotón | |
| Acetato de metilo | pegamento | |
| Antranilato de metilo | uva , jazmín | |
| Benzoato de metilo | afrutado, ylang ylang , feijoa | |
| Butirato de metilo (butanoato de metilo) | piña , manzana , fresa | |
| Cinamato de metilo | fresa | |
| Pentanoato de metilo (valerato de metilo) | florido | |
| Fenilacetato de metilo | cariño | |
| Salicilato de metilo ( aceite de gaulteria ) | Ungüentos modernos de cerveza de raíz , gaulteria , Germolene y Ralgex (Reino Unido) | |
| Caprilato de nonilo | naranja | |
| Acetato de octilo | afrutado- naranja | |
| Butirato de octilo | chirivía | |
| Acetato de amilo (acetato de pentilo) | manzana , plátano | |
| Butirato de pentilo (butirato de amilo) | albaricoque , pera , piña | |
| Hexanoato de pentilo (caproato de amilo) | manzana , piña | |
| Pentanoato de pentilo (valerato de amilo) | manzana | |
| Acetato de propilo | pera | |
| Hexanoato de propilo | mora , piña , queso , vino | |
| Isobutirato de propilo | Ron | |
| Butirato de terpenilo | cereza |
Ver también [ editar ]
- Lista de ésteres
- Amida , un éster análogo con oxígeno reemplazado por nitrógeno.
- Éster de cianato
- Oligoéster
- Poliolester
- Tioéster , un éster análogo con oxígeno reemplazado por azufre
- Transesterificación
- Éter lípido
Referencias [ editar ]
- ^ IUPAC , Compendio de terminología química , 2ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) " ésteres ". doi : 10.1351 / goldbook.E02219
- ^ Cameron Wright (1986). Una guía del trabajador sobre los peligros de los solventes . El grupo. pag. 48. ISBN 9780969054542.
- ^ E. Richard Booser (21 de diciembre de 1993). Manual CRC de Lubricación y Tribología, Volumen III: Monitoreo, Materiales, Lubricantes Sintéticos y Aplicaciones . CRC. pag. 237. ISBN 978-1-4200-5045-5.
- ^ Leopold Gmelin, Handbuch der Chemie , vol. 4: Handbuch der organischen Chemie (vol. 1) (Heidelberg, Baden (Alemania): Karl Winter, 1848), página 182 .
Texto original:
Traducción:B. Ester oder sauerstoffsäure Aetherarten.
Ethers du troisième género.
Viele mineralische und organische Sauerstoffsäuren treten mit einer Alkohol-Art unter Ausscheidung von Wasser zu neutralen flüchtigen ätherischen Verbindungen zusammen, welche man als gepaarte Verbindungen von Alkohol und Säuren-Wasser ken eden eden, nachten der Radsicalzenorie, nachten der Radsicalzenorie. Aether verbunden ist.B. Éteres de éster u oxiácido.
Éteres del tercer tipo.
Muchos ácidos minerales y orgánicos que contienen oxígeno se combinan con un alcohol al eliminar el agua para [formar] compuestos de éter volátiles neutros, que se pueden ver como compuestos acoplados de alcohol y ácido-agua, o, según la teoría de los radicales, como sales. en el que un ácido está enlazado con un éter. - ↑ a b March, J. Advanced Organic Chemistry 4ta Ed. J. Wiley and Sons, 1992: Nueva York. ISBN 0-471-60180-2 .
- ^ Química de Enols y Enolates - Acidez de los alfa-hidrógenos
- ^ Diwakar M. Pawar; Abdelnaser A. Khalil; Denise R. Hooks; Kenneth Collins; Tijuana Elliott; Jefforey Stafford; Lucille Smith; Eric A. Noe (1998). " Conformaciones E y Z de ésteres, ésteres de tiol y amidas". Mermelada. Chem. Soc. 120 (9): 2108–2112. doi : 10.1021 / ja9723848 .
- ^ Christophe Dugave; Luc Demange (2003). "Isomerización cis-trans de moléculas orgánicas y biomoléculas: implicaciones y aplicaciones". Chem. Rev. 103 (7): Chem. Rev. doi : 10.1021 / cr0104375 . PMID 12848578 .
- ^ AA Yakovenko, JH Gallegos, M. Yu. Antipin, A. Masunov, TV Timofeeva (2011). "Morfología cristalina como evidencia de organización supramolecular en aductos de 1,2-bis (cloromercurio) tetrafluorobenceno con ésteres orgánicos". Cryst. Crecimiento Des . 11 (9): 3964–3978. doi : 10.1021 / cg200547k .Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Aislamiento de triglicéridos de nuez moscada: Síntesis orgánica GD Beal "Trimyristen", Coll. Vol. 1, pág. 538 (1941). Enlace
- ^ McGee, Harold. Sobre comida y cocina '. 2003, Scribner, Nueva York.
- ↑ a b c d e Riemenschneider, Wilhelm; Bolt, Hermann M. "Ésteres orgánicos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a09_565.pub2 .
- ^ Williams, Roger J .; Gabriel, Alton; Andrews, Roy C. (1928). "La relación entre la constante de equilibrio de hidrólisis de ésteres y la fuerza de los ácidos correspondientes". Mermelada. Chem. Soc . 50 (5): 1267–1271. doi : 10.1021 / ja01392a005 .
- ^ B. Neises y W. Steglich. "Esterificación de ácidos carboxílicos con diciclohexilcarbodiimida / 4-dimetilaminopiridina: tert - butil etil fumarato" . Síntesis orgánicas .; Volumen colectivo , 7 , p. 93
- ^ Matsumoto, Kouichi; Shimazaki, Hayato; Miyamoto, Yu; Shimada, Kazuaki; Haga, Fumi; Yamada, Yuki; Miyazawa, Hirotsugu; Nishiwaki, Keiji; Kashimura, Shigenori (2014). "Síntesis simple y conveniente de ésteres de ácidos carboxílicos y haluros de alquilo usando fluoruro de tetrabutilamonio" . Revista de Oleo Science . 63 (5): 539–544. doi : 10.5650 / jos.ess13199 . ISSN 1345-8957 . PMID 24770480 .
- ↑ Kamm, O .; Kamm, WF (1922). "Benzoato de bencilo" . Síntesis orgánicas . 2 : 5. doi : 10.15227 / orgsyn.002.0005 .; Volumen colectivo , 1 , p. 104
- ↑ Ignatyev, Igor; Charlie Van Doorslaer; Pascal GN Mertens; Koen Binnemans; Puñal. E. de Vos (2011). "Síntesis de ésteres de glucosa a partir de celulosa en líquidos iónicos" . Holzforschung . 66 (4): 417–425. doi : 10.1515 / hf.2011.161 . S2CID 101737591 .
- ^ Neumeister, Joachim; Keul, Helmut; Pratap Saxena, Mahendra; Griesbaum, Karl (1978). "Escisión por ozono de olefinas con formación de fragmentos de éster". Angewandte Chemie International Edition en inglés . 17 (12): 939–940. doi : 10.1002 / anie.197809392 .
- ↑ Makhova, Irina V .; Elinson, Michail N .; Nikishin, Gennady I. (1991). "Oxidación electroquímica de cetonas en metanol en presencia de bromuros de metales alcalinos". Tetraedro . 47 (4–5): 895–905. doi : 10.1016 / S0040-4020 (01) 87078-2 .
- ^ W. Reusch. "Reactividad del derivado carboxilo" . Libro de texto virtual de química orgánica . Archivado desde el original el 16 de mayo de 2016.
- ^ Yato, Michihisa; Homma, Koichi; Ishida, Akihiko (junio de 2001). "Reducción de ésteres carboxílicos a éteres con trietilsilano en el uso combinado de tetracloruro de titanio y trifluorometanosulfonato de trimetilsililo". Tetraedro . 57 (25): 5353–5359. doi : 10.1016 / S0040-4020 (01) 00420-3 .
- ^ Sakai, Norio; Moriya, Toshimitsu; Konakahara, Takeo (julio de 2007). "Una síntesis eficiente de un solo recipiente de éteres asimétricos: una desoxigenación directamente reductora de ésteres utilizando un sistema catalítico InBr3 / Et3SiH". La Revista de Química Orgánica . 72 (15): 5920–5922. doi : 10.1021 / jo070814z . PMID 17602594 .
- ^ Madera, JL; Khatri, NA; Weinreb, SM (1979). "Una conversión directa de ésteres en nitrilos". Letras de tetraedro . 20 (51): 4907. doi : 10.1016 / S0040-4039 (01) 86746-0 .
Enlaces externos [ editar ]
| Wikiquote tiene citas relacionadas con: Ester |
- Introducción a los ésteres
- Molécula del mes: acetato de etilo y otros ésteres