| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Ácido sulfuroclorídico | |||
| Otros nombres Ácido clorosulfúrico, ácido clorosulfónico, ácido clorosulfónico, ácido Chlorinesulfonic, ácido Chlorinesulphonic, ácido Chloridosulfonic, ácido Chloridosulphonic, clorhidrina sulfúrico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.029.304 | ||
| Número CE |
| ||
PubChem CID | |||
| Número RTECS |
| ||
| UNII | |||
| un numero | 1754 | ||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
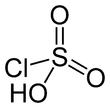
| HSO 3 Cl | |||
| Masa molar | 116,52 g mol −1 | ||
| Apariencia | líquido incoloro | ||
| Densidad | 1,753 g cm −3 | ||
| Punto de fusion | −80 ° C (−112 ° F; 193 K) | ||
| Punto de ebullición | 151 a 152 ° C (304 a 306 ° F; 424 a 425 K) (755 mmHg o 100,7 kPa) | ||
| hidrólisis | |||
| Solubilidad en otros disolventes. | reacciona con alcoholes solubles en clorocarbonos | ||
Índice de refracción ( n D ) | 1.433 | ||
| Estructura | |||
| tetraédrico | |||
| Peligros | |||
| Ficha de datos de seguridad | ICSC 1039 | ||
| Pictogramas GHS |   | ||
| Palabra de señal GHS | Peligro | ||
| H314 , H335 | |||
| P260 , P261 , P264 , P271 , P280 , P301 + 330 + 331 , P303 + 361 + 353 , P304 + 340 , P305 + 351 + 338 , P310 , P312 , P321 , P363 , P403 + 233 , P405 , P501 | |||
| NFPA 704 (diamante de fuego) | |||
| Compuestos relacionados | |||
Compuestos relacionados | Cloruro de sulfurilo Ácido sulfúrico | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
El ácido clorosulfúrico ( nombre IUPAC : ácido sulfuroclorídico ) es el compuesto inorgánico con la fórmula HSO 3 Cl. También se le conoce como ácido clorosulfónico , siendo el ácido sulfónico del cloro . Es un líquido destilable, incoloro, higroscópico y potente lacrimógeno . [2]
Las sales y ésteres de ácido clorosulfúrico se conocen como clorosulfatos .
Estructura y propiedades [ editar ]
El ácido clorosulfúrico es una molécula tetraédrica . La fórmula se escribe de forma más descriptiva SO 2 (OH) Cl, pero HSO 3 Cl es tradicional. Es un intermedio, química y conceptualmente, entre el cloruro de sulfurilo (SO 2 Cl 2 ) y el ácido sulfúrico (H 2 SO 4 ). [3] El compuesto rara vez se obtiene puro. Al reposar con un exceso de trióxido de azufre, se descompone en cloruros de pirosulfurilo: [4]
- 2 ClSO 3 H + SO 3 → H 2 SO 4 + S 2 O 5 Cl 2
Síntesis [ editar ]
La síntesis industrial implica la reacción del cloruro de hidrógeno con una solución de trióxido de azufre en ácido sulfúrico : [4]
- HCl + SO 3 → ClSO 3 H
También se puede preparar mediante cloración de ácido sulfúrico, escrito aquí con fines pedagógicos como HSO 3 (OH), frente al formato habitual H 2 SO 4 :
- PCl 5 + HSO 3 (OH) → HSO 3 Cl + POCl 3 + HCl
El último método es más adecuado para operaciones a escala de laboratorio.
Aplicaciones [ editar ]
El ClSO 2 OH se utiliza para preparar alquilsulfatos , que son útiles como detergentes y como productos químicos intermedios:
- ROH + ClSO 3 H → ROSO 3 H + HCl
Una síntesis temprana de sacarina comienza con la reacción del tolueno con ClSO 2 OH para dar los derivados de cloruro de orto y paratoluenosulfonilo :
- CH 3 C 6 H 5 + 2 ClSO 2 OH → CH 3 C 6 H 4 SO 2 Cl + H 2 SO 4 + HCl
La oxidación del isómero orto da el derivado del ácido benzoico que luego se cicla con amoniaco y se neutraliza con una base para producir sacarina.
El ácido clorosulfónico se ha utilizado como agente anti- estelas en drones de reconocimiento Ryan Modelo 147 , [5] y para producir cortinas de humo . [6] [7]
Seguridad [ editar ]
El ClSO 3 H reacciona violentamente con el agua para producir ácido sulfúrico y cloruro de hidrógeno, que comúnmente se ven como vapores que emanan del líquido:
- ClSO 3 H + H 2 O → H 2 SO 4 + HCl
Deben observarse las precauciones, como la ventilación adecuada, asociadas con el HCl.
Ácidos halosulfúricos relacionados [ editar ]
- El ácido fluorosulfónico , FSO 2 OH, es un ácido fuerte relacionado con una tendencia disminuida a desarrollar fluoruro de hidrógeno .
- El ácido bromosulfónico , BrSO 2 OH, es inestable y se descompone en su punto de fusión de 8 ° C para dar bromo , dióxido de azufre y ácido sulfúrico .
- No se conoce la presencia de ácido yodosulfónico.
Referencias [ editar ]
- ^ http://www.newenv.com/resources/nfpa_chemicals
- ^ Cremlyn, RJ (2002). Ácido clorosulfónico . Real Sociedad de Química. ISBN 978-0-85404-498-6.
- ^ Holleman, AF; Wiberg, E. (2001). Química inorgánica . San Diego: Prensa académica. págs. 549–550.
- ^ a b Maas, J .; Baunack, F. (2002). "Ácido clorosulfúrico". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a07_017 . ISBN 3527306730.
- ^ Método y aparato para suprimir las estelas de condensación (PDF) . Oficina de Patentes y Marcas de Estados Unidos. 1970.
- ^ La Royal Navy en guerra (DVD). Londres: Museo Imperial de la Guerra . 2005.
- ↑ Amos, Jonathan (11 de abril de 2018). "Legado nazi encontrado en árboles noruegos" . BBC News Online . Consultado el 17 de abril de 2018 .