Complejo de coordinación
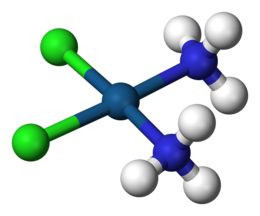
Un complejo de coordinación consta de un átomo o ión central , que generalmente es metálico y se denomina centro de coordinación , y una matriz circundante de moléculas o iones unidos , que a su vez se conocen como ligandos o agentes complejantes. [1] [2] [3] Muchos compuestos que contienen metales , especialmente aquellos que incluyen metales de transición (elementos como el titanio que pertenecen al bloque d de la tabla periódica ), son complejos de coordinación. [4]
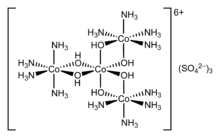
Los complejos de coordinación son tan omnipresentes que sus estructuras y reacciones se describen de muchas formas, a veces de manera confusa. El átomo dentro de un ligando que está unido al ión o átomo metálico central se llama átomo donante . En un complejo típico, un ión metálico se une a varios átomos donantes, que pueden ser iguales o diferentes. Un ligando polidentado (con enlaces múltiples) es una molécula o ión que se une al átomo central a través de varios de los átomos del ligando; son comunes los ligandos con 2, 3, 4 o incluso 6 enlaces al átomo central. Estos complejos se denominan complejos de quelatos ; la formación de tales complejos se llama quelación, complejación y coordinación.
El átomo o ión central, junto con todos los ligandos, comprenden la esfera de coordinación . [5] [6] Los átomos o iones centrales y los átomos donantes comprenden la primera esfera de coordinación.
La coordinación se refiere a los "enlaces covalentes coordinados" ( enlaces dipolares ) entre los ligandos y el átomo central. Originalmente, un complejo implicaba una asociación reversible de moléculas , átomos o iones a través de enlaces químicos tan débiles . Aplicado a la química de la coordinación, este significado ha evolucionado. Algunos complejos metálicos se forman de forma prácticamente irreversible y muchos están unidos por enlaces que son bastante fuertes. [7] [8]
El número de átomos donantes unidos al átomo o ion central se llama número de coordinación . Los números de coordinación más comunes son 2, 4 y especialmente 6. Un ion hidratado es un tipo de ion complejo (o simplemente un complejo), una especie formada entre un ion metálico central y uno o más ligandos, moléculas o iones circundantes que contienen al menos un par solitario de electrones.
Si todos los ligandos son monodentados , entonces el número de átomos donantes es igual al número de ligandos. Por ejemplo, el ion cobalto (II) hexahidrato o el ion hexaaquacobalto (II) [Co (H 2 O) 6 ] 2+ es un ion de complejo hidratado que consta de seis moléculas de agua unidas a un ion metálico Co. El estado de oxidación y el número de coordinación refleja el número de enlaces formados entre el ión metálico y los ligandos en el ión complejo. Sin embargo, el número de coordinación de Pt ( en )2+
2 es 4 (en lugar de 2) ya que tiene dos ligandos bidentados, que contienen cuatro átomos donantes en total.