 | |
| Nombres | |
|---|---|
| Nombre IUPAC Carbonato de cobre (II) | |
| Otros nombres Carbonato cúprico, carbonato de cobre neutro | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.013.338 |
| Número CE |
|
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| CuCO 3 | |
| Masa molar | 123.5549 |
| Apariencia | polvo gris [1] |
| reacciona con el agua en condiciones normales | |
| Estructura | |
| Pa-C 2 s (7) [1] | |
a = 6.092 Å, b = 4.493 Å, c = 7.030 Å α = 90 °, β = 101,34 °°, γ = 90 ° | |
| 5 [1] | |
| Peligros | |
| punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
Otros aniones | Sulfato de cobre (II) |
Otros cationes | Carbonato de níquel (II) Carbonato de zinc |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
El carbonato de cobre (II) o carbonato cúprico es un compuesto químico con fórmula CuCO
3. A temperatura ambiente, es un sólido iónico (una sal ) que consta de cationes de cobre (II) Cu 2+
y aniones de carbonato CO 2−
3.
Este compuesto rara vez se encuentra porque es difícil de preparar [2] y reacciona fácilmente con la humedad del agua del aire. Los términos "carbonato de cobre", "carbonato de cobre (II)" y "carbonato cúprico" casi siempre se refieren (incluso en los textos de química) a un carbonato de cobre básico (o hidróxido de carbonato de cobre (II) ), como Cu
2( OH ) 2 CO
3(que se produce naturalmente como el mineral malaquita ) o Cu
3( OH ) 2 ( CO
3) 2 ( azurita ). Por esta razón, el calificador neutral puede usarse en lugar de "básico" para referirse específicamente a CuCO.
3.
Preparación [ editar ]
Reacciones que se pueden esperar que produzcan CuCO
3, como soluciones de mezcla de sulfato de cobre (II) CuSO
4y carbonato de sodio Na
2CO
3en condiciones ambientales , produce en su lugar un carbonato básico y CO
2, debido a la gran afinidad del Cu2+
ion para el anión hidróxido HO-
. [3]
La descomposición térmica del carbonato básico a presión atmosférica produce óxido de cobre (II) CuO en lugar del carbonato.
En 1960, CWFT Pistorius reclamó la síntesis calentando carbonato de cobre básico a 180 ° C en una atmósfera de dióxido de carbono CO
2(450 atm ) y agua (50 atm) durante 36 horas. La mayor parte de los productos era malaquita Cu bien cristalizada.
2CO
3( OH ) 2 , pero también se obtuvo un pequeño rendimiento de una sustancia romboédrica, que se dice que es CuCO
3. [4] Sin embargo, esta síntesis aparentemente no fue reproducida. [2]
Hartmut Ehrhardt y otros informaron por primera vez en 1973 de una síntesis confiable de carbonato de cobre (II) verdadero . El compuesto se obtuvo como un polvo gris, calentando carbonato de cobre básico en una atmósfera de dióxido de carbono (producido por la descomposición del oxalato de plata Ag
2C
2O
4) a 500 ° C y 2 G Pa (20.000 atm). Se determinó que el compuesto tenía una estructura monoclínica . [5]
Propiedades químicas y físicas [ editar ]
La estabilidad del CuCO seco
3depende críticamente de la presión parcial de dióxido de carbono (p CO2 ). Es estable durante meses en aire seco, pero se descompone lentamente en CuO y CO
2si p CO2 es menor que 0.11 atm. [6]
En presencia de agua o aire húmedo a 25 ° C, CuCO
3es estable solo para p CO2 por encima de 4.57 atmósferas y pH entre aproximadamente 4 y 8. [7] Por debajo de esa presión parcial, reacciona con el agua para formar un carbonato básico ( azurita , Cu
3( CO
3) 2 ( OH ) 2 ). [6]
- 3 CuCO
3+ H
2O → Cu
3(CO
3)
2(OH)
2+ CO
2
En soluciones muy básicas, el anión complejo Cu ( CO
3) 2 2− se forma en su lugar. [6]
El producto de solubilidad del carbonato de cobre (II) verdadero fue medido por Reiterer y otros como pK so = 11,45 ± 0,10 a 25 ° C. [2] [6] [8]
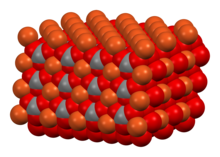
Estructura [ editar ]
En la estructura cristalina de CuCO 3 , el cobre adopta un entorno de coordinación piramidal cuadrada distorsionada con número de coordinación 5. Cada ion carbonato se une a 5 centros de cobre. [1]
Celda unitaria de CuCO 3
Entorno de coordinación de cobre
Entorno de coordinación de carbonatos
Referencias [ editar ]
- ↑ a b c d H. Seidel, H. Ehrhardt, K. Viswanathan, W. Johannes (1974): "Darstellung, Struktur und Eigenschaften von Kupfer (II) -Carbonat". Z. anorg. allg. Chem., Volumen 410, páginas 138-148. doi : 10.1002 / zaac.19744100207
- ^ a b c Rolf Grauer (1999) " Productos de solubilidad de carbonatos M (II) ". Informe Técnico NTB-99-03, NAGRA - Cooperativa Nacional para la Eliminación de Desechos Radiactivos; páginas 8, 14 y 17. Traducido por U. Berner.
- ^ Ahmad, Zaki (2006). Principios de ingeniería de corrosión y control de corrosión . Oxford: Butterworth-Heinemann. págs. 120–270. ISBN 9780750659246.
- ^ CWFT Pistorius (1960): "Síntesis a alta presión y constantes de celosía de carbonato cúprico normal". Experientia, volumen XVI, páginas 447-448. doi : 10.1007 / BF02171142
- ^ Hartmut Erhardt, Wilhelm Johannes y Hinrich Seidel (1973): "Hochdrucksynthese von Kupfer (II) -Carbonat", Z. Naturforsch., Volumen 28b, número 9-10, página 682. doi : 10.1515 / znb-1973-9 -1021
- ^ a b c d F. Reiterer, W. Johannes, H. Gamsjäger (1981): "Determinación semimicro de las constantes de solubilidad: carbonato de cobre (II) y carbonato de hierro (II)". Mikrochim. Acta, tomo 1981, página 63. doi : 10.1007 / BF01198705
- ^ H. Gamsjäger y W. Preis (1999): "Contenido de cobre en carbonato de cobre sintético". Carta a J. Chem. Educ., Volumen 76, número 10, página 1339. doi : 10.1021 / ed076p1339.1
- ^ F. Reiterer (1980): "Löslichkeitskonstanten und Freie Bildungsenthalpien neutraler Übergangsmetallcarbonate". Tesis, Montanuniversität Leoben.