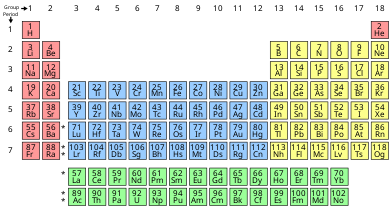
Grupo (tabla periódica)
En química , un grupo (también conocido como familia [1] ) es una columna de elementos en la tabla periódica de los elementos químicos . Hay 18 grupos numerados en la tabla periódica; las columnas del bloque f (entre los grupos 2 y 3) no están numeradas. Los elementos de un grupo tienen características físicas o químicas similares de las capas de electrones más externas de sus átomos (es decir, la misma carga central ), porque la mayoría de las propiedades químicas están dominadas por la ubicación orbital del electrón más externo.
Hay tres sistemas de numeración de grupos para los grupos; el mismo número puede asignarse a diferentes grupos según el sistema que se utilice. El sistema de numeración moderno de "grupo 1" a "grupo 18" ha sido recomendado por la Unión Internacional de Química Pura y Aplicada (IUPAC) desde aproximadamente 1990. Reemplaza dos esquemas de nombres incompatibles anteriores, utilizados por el Servicio de Resumen Químico (CAS, más popular en los EE. UU.), y por IUPAC antes de 1990 (más popular en Europa). El sistema de dieciocho grupos es generalmente aceptado por la comunidad química, pero existe cierta disidencia sobre la pertenencia de varios elementos. Los desacuerdos involucran principalmente a los elementos número 1 y 2 ( hidrógeno y helio ), así como ametales de transición interna .
Los grupos también pueden identificarse utilizando su elemento superior o tener un nombre específico. Por ejemplo, el grupo 16 también se describe como el "grupo de oxígeno" y como los " calcógenos ". Una excepción es el " grupo del hierro ", que generalmente se refiere al " grupo 8 ", pero en química también puede significar hierro , cobalto y níquel , o algún otro conjunto de elementos con propiedades químicas similares. En astrofísica y física nuclear , generalmente se refiere al hierro , cobalto , níquel , cromo y manganeso .
Existen dos sistemas de numeración de grupos anteriores: CAS ( Chemical Abstracts Service ) y la antigua IUPAC . Ambos usan números ( árabes o romanos ) y letras A y B. Ambos sistemas coinciden en los números. Los números indican aproximadamente el número de oxidación más alto de los elementos de ese grupo, por lo que indican una química similar con otros elementos con el mismo número. El número procede de forma linealmente creciente en su mayor parte, una vez a la izquierda de la tabla y otra vez a la derecha (ver Lista de estados de oxidación de los elementos), con algunas irregularidades en los metales de transición. Sin embargo, los dos sistemas usan las letras de manera diferente. Por ejemplo, el potasio (K) tiene un electrón de valencia. Por lo tanto, se encuentra en el grupo 1. El calcio (Ca) está en el grupo 2, ya que contiene dos electrones de valencia.
En el antiguo sistema IUPAC, las letras A y B se designaban en la parte izquierda (A) y derecha (B) de la tabla, mientras que en el sistema CAS, las letras A y B se designaban para los elementos del grupo principal (A) y los elementos de transición. (B). El antiguo sistema IUPAC se usaba con frecuencia en Europa, mientras que el CAS es más común en América. El nuevo esquema de la IUPAC se desarrolló para reemplazar ambos sistemas, ya que usaban confusamente los mismos nombres para significar cosas diferentes. El nuevo sistema simplemente enumera los grupos de forma creciente de izquierda a derecha en la tabla periódica estándar. La propuesta de la IUPAC se distribuyó por primera vez en 1985 para comentarios públicos, [2] y luego se incluyó como parte de la edición de 1990 de la Nomenclatura de Química Inorgánica . [11]