 | |
 | |
| Datos clinicos | |
|---|---|
| Nombres comerciales | Rukobia |
| Otros nombres | BMS-663068, GSK3684934 |
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a620046 |
| Datos de licencia |
|
| Vías de administración | Oral |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Tablero CompTox ( EPA ) | |
| Datos químicos y físicos | |
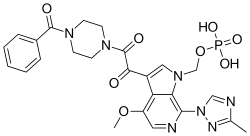
| Fórmula | C 25 H 26 N 7 O 8 P |
| Masa molar | 583,498 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
Fostemsavir , vendido bajo la marca Rukobia , es un medicamento antirretroviral para adultos que viven con el VIH / SIDA que han probado múltiples medicamentos contra el VIH y cuya infección por el VIH no puede tratarse con éxito con otras terapias debido a la resistencia, intolerancia o consideraciones de seguridad. [1] [3]
La reacción adversa más común son las náuseas. [1] [3] [4] Las reacciones adversas graves incluyeron elevaciones de las enzimas hepáticas entre los participantes también infectados con el virus de la hepatitis B o C y cambios en el sistema inmunológico (síndrome de reconstitución inmunitaria). [3]
Fostemsavir es un inhibidor de la entrada del VIH y un profármaco de temsavir (BMS-626529). [5] Fostemsavir es un inhibidor de la unión dirigido a gp120 del virus de la inmunodeficiencia humana tipo 1 (VIH-1). [6]
Fue aprobado para uso médico en los Estados Unidos en julio de 2020, [3] [4] [6] y en la Unión Europea en febrero de 2021. [2] La Administración de Drogas y Alimentos de los Estados Unidos (FDA) considera que es la primera vez -medicación de su clase . [7]
Usos médicos
Fostemsavir en combinación con otro (s) antirretroviral (s), está indicado para el tratamiento de la infección por VIH-1 en adultos con mucha experiencia en el tratamiento con infección por VIH-1 resistente a múltiples fármacos que falla en su régimen antirretroviral actual debido a resistencia, intolerancia o consideraciones de seguridad. [6]
Efectos adversos
El fostemsavir puede causar una afección grave llamada síndrome de reconstitución inmunitaria, similar a otros medicamentos aprobados para el tratamiento de la infección por VIH-1. [4] Esta afección puede ocurrir al comienzo del tratamiento del VIH-1, cuando el sistema inmunológico puede fortalecerse y comenzar a combatir infecciones que han estado ocultas en el cuerpo durante mucho tiempo. [4] Otros efectos secundarios graves incluyen problemas del ritmo cardíaco debido a la prolongación de la actividad eléctrica del corazón (prolongación del intervalo QT) y un aumento de las enzimas hepáticas en pacientes con coinfección por el virus de la hepatitis B o C. [4]
Historia
Fue bajo desarrollo por ViiV Healthcare / GlaxoSmithKline para uso en el tratamiento de la infección por VIH. Al bloquear el receptor gp120 del virus, evita la unión viral inicial a la célula T CD4 + del huésped y la entrada a la célula inmunitaria del huésped; su método de acción es el primero para los medicamentos contra el VIH. [8] Debido a que se dirige a un paso diferente del ciclo de vida viral, es prometedor para las personas con virus que se han vuelto altamente resistentes a otros medicamentos contra el VIH . [9] Dado que gp120 es un área muy conservada del virus, es poco probable que el fármaco promueva la resistencia a sí mismo. [10] Los investigadores encontraron que la enfuvirtidaLos sobres de VIH resistentes y resistentes a ibalizumab siguieron siendo sensibles a Fostemsavir. Por el contrario, el VIH resistente a fostemsavir siguió siendo susceptible a todos los inhibidores de entrada. Además, los aislados de VIH que no requieren el receptor CD4 para la entrada celular también fueron susceptibles a Fostemsavir, y el virus no escapó del inhibidor de la unión al volverse independiente de CD4. Estudios in vitro anteriores demostraron que Fostemsavir inhibe el VIH tanto CCR5 -tropico como CXCR4 -tropico. [8]

Fostemsavir fue aprobado para uso médico en los Estados Unidos en julio de 2020. [3] [4] [6]
La seguridad y eficacia de fostemsavir, tomado dos veces al día por vía oral, se evaluó en un ensayo clínico de 371 participantes adultos con mucha experiencia en el tratamiento que continuaron teniendo niveles altos de virus (VIH-ARN) en la sangre a pesar de estar tomando medicamentos antirretrovirales. [3] Doscientos setenta y dos participantes fueron tratados en el brazo principal del ensayo y 99 participantes adicionales recibieron fostemsavir en un brazo diferente del ensayo. [3] [4] La mayoría de los participantes habían recibido tratamiento contra el VIH durante más de 15 años (71 por ciento), habían estado expuestos a cinco o más regímenes diferentes de tratamiento del VIH antes de ingresar al ensayo (85 por ciento) y / o tenían antecedentes de SIDA (86 por ciento). [3]Los participantes de la cohorte principal del ensayo recibieron fostemsavir o un placebo dos veces al día durante ocho días, además de su régimen antirretroviral fallido. [3] [4] En el octavo día, los participantes tratados con fostemsavir tuvieron una disminución significativamente mayor en los niveles de ARN-VIH en la sangre en comparación con los que tomaron el placebo. [3] Después del octavo día, todos los participantes recibieron fostemsavir con otros medicamentos antirretrovirales. [3] [4] Después de 24 semanas de fostemsavir más otros medicamentos antirretrovirales, el 53 por ciento de los participantes lograron la supresión del ARN del VIH, donde los niveles del VIH eran lo suficientemente bajos como para ser considerados indetectables. [3] Después de 96 semanas, el 60 por ciento de los participantes continuó teniendo supresión del ARN del VIH.[3]
El ensayo clínico (NCT02362503) se llevó a cabo en 108 sitios en 23 países de América del Norte, América del Sur, Europa, Australia, Taiwán y Sudáfrica. [4]
La Administración de Drogas y Alimentos de los EE. UU . (FDA) otorgó la solicitud para las designaciones de terapia de avance rápido , revisión prioritaria y terapia innovadora de fostemsavir . [3] La FDA otorgó la aprobación de Rukobia a ViiV Healthcare. [3]
El 10 de diciembre de 2020, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Rukobia, destinado al tratamiento de múltiples fármacos. infección por VIH-1 resistente. [11] El solicitante de este medicamento es ViiV Healthcare BV Fostemsavir fue aprobado para uso médico en la Unión Europea en febrero de 2021. [2]
Referencias
- ^ a b c "Tableta de trometamina de Rukobia- fostemsavir, recubierta con película, liberación prolongada" . DailyMed . 2 de julio de 2020 . Consultado el 14 de julio de 2020 .
- ^ a b c "EPAR de Rukobia" . Agencia Europea de Medicamentos (EMA) . 9 de diciembre de 2020 . Consultado el 12 de febrero de 2021 .
- ^ a b c d e f g h i j k l m n o "La FDA aprueba un nuevo tratamiento contra el VIH para pacientes con opciones de tratamiento limitadas" . Administración de Drogas y Alimentos de los EE. UU. (Comunicado de prensa). 2 de julio de 2020 . Consultado el 2 de julio de 2020 .
 Este artículo incorpora texto de esta fuente, que es de dominio público .
Este artículo incorpora texto de esta fuente, que es de dominio público . - ^ a b c d e f g h i j "Instantáneas de ensayos de drogas: Rukobia" . EE.UU. Administración de Drogas y Alimentos (FDA) . 2 de julio de 2020 . Consultado el 14 de julio de 2020 .
 Este artículo incorpora texto de esta fuente, que es de dominio público .
Este artículo incorpora texto de esta fuente, que es de dominio público . - ^ Lai, Yen-Ting; Wang, Tao; O'Dell, Sijy; Más fuerte, Mark K .; Schön, Arne; Cheung, Crystal SF; Chuang, Gwo-Yu; Druz, Aliaksandr; Lin, Bob; McKee, Krisha; Peng, Dongjun (3 de enero de 2019). "La ingeniería de celosía permite la definición de características moleculares que permiten una potente inhibición de la entrada del VIH-1 por moléculas pequeñas" . Comunicaciones de la naturaleza . 10 (1): 47. Bibcode : 2019NatCo..10 ... 47L . doi : 10.1038 / s41467-018-07851-1 . ISSN 2041-1723 . PMC 6318274 . PMID 30604750 .
- ^ a b c d "ViiV Healthcare anuncia la aprobación de la FDA de EE. UU. para Rukobia (fostemsavir), un primer tratamiento para el VIH en adultos con pocas opciones de tratamiento disponibles" (Comunicado de prensa). ViiV Healthcare. 2 de julio de 2020 . Consultado el 2 de julio de 2020 , a través de Business Wire.
- ^ "Aprobaciones de nuevas terapias farmacológicas 2020" . EE.UU. Administración de Drogas y Alimentos (FDA) . 31 de diciembre de 2020 . Consultado el 17 de enero de 2021 .
 Este artículo incorpora texto de esta fuente, que es de dominio público .
Este artículo incorpora texto de esta fuente, que es de dominio público . - ^ a b El inhibidor del apego al VIH BMS-663068 se ve bien en los primeros estudios
- ^ El inhibidor de la unión al VIH BMS-663068 muestra una buena seguridad y eficacia en el estudio de fase 2b
- ^ Actividad del inhibidor de la unión del VIH-1 BMS-626529, el componente activo del profármaco BMS-663068, contra virus independientes de CD4 y envolturas de VIH-1 resistentes a otros inhibidores de la entrada
- ^ "Rukobia: pendiente de decisión de la CE" . Agencia Europea de Medicamentos (EMA) . 11 de diciembre de 2020 . Consultado el 11 de diciembre de 2020 .El texto se copió de esta fuente que es © Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
Lectura adicional
- Kozal M, Aberg J, Pialoux G, Cahn P, Thompson M, Molina JM, et al. (Marzo de 2020). "Fostemsavir en adultos con infección por VIH-1 resistente a múltiples fármacos" . N. Engl. J. Med . 382 (13): 1232-1243. doi : 10.1056 / NEJMoa1902493 . PMID 32212519 .
Enlaces externos
- "Fostemsavir" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.
- "Fostemsavir trometamina" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.
- Número de ensayo clínico NCT02362503 para "Comparación de inhibidores de la unión en pacientes con mucha experiencia en el tratamiento" en ClinicalTrials.gov