
El receptor GABA A ( GABA A R ) es un receptor ionotrópico y un canal iónico controlado por ligando . Su ligando endógeno es el ácido γ-aminobutírico (GABA), el principal neurotransmisor inhibidor del sistema nervioso central . Al abrirse, el receptor GABA A es selectivamente permeable a los iones cloruro (Cl - ) y, en menor grado, a los iones bicarbonato (HCO 3 - ). [4] [5] Dependiendo del potencial de membranay la diferencia de concentración iónica, esto puede resultar en flujos iónicos a través del poro. Por ejemplo, en condiciones fisiológicas, el Cl - fluirá dentro de la célula si el potencial de membrana es mayor que el potencial de equilibrio (también conocido como potencial de inversión) para los iones de cloruro si el receptor está activado. [6] Esto causa un efecto inhibidor sobre la neurotransmisión al disminuir la posibilidad de que ocurra un potencial de acción exitoso en la célula postsináptica. El potencial de inversión del potencial postsináptico inhibidor (IPSP) mediado por GABA A en solución normal es de -70 mV, en contraste con el IPSP de GABA B (-100 mV).
El sitio activo de la GABA A receptor es el sitio de unión para GABA y varios fármacos como muscimol , gaboxadol , y bicuculina . [7] La proteína también contiene varios sitios de unión alostéricos diferentes que modulan indirectamente la actividad del receptor. Estos sitios alostéricos son el objetivo de varios otros fármacos, incluidas las benzodiazepinas , no benzodiazepinas , esteroides neuroactivos , barbitúricos , alcohol (etanol), [8] anestésicos inhalados , kavalactonas.y picrotoxina , entre otros. [9]
Los receptores GABA A se encuentran en todos los organismos que tienen un sistema nervioso. Hasta cierto punto, los receptores se pueden encontrar en tejidos no neuronales. Debido a su amplia distribución dentro del sistema nervioso de los mamíferos, desempeñan un papel en prácticamente todas las funciones cerebrales.
Objetivo para las benzodiazepinas [ editar ]
El complejo proteico ionotrópico del receptor GABA A es también el objetivo molecular de la clase de fármacos tranquilizantes de las benzodiazepinas . Las benzodiazepinas no se unen al mismo sitio receptor en el complejo proteico que el ligando endógeno GABA (cuyo sitio de unión se encuentra entre las subunidades α y β), sino que se unen a distintos sitios de unión de las benzodiazepinas situados en la interfaz entre α y γ. -subunidades de las subunidades α y γ que contienen receptores GABA A. [10] [11] Si bien la mayoría de los receptores GABA A (los que contienen α 1 -, α 2 -, α 3 - o α 5-subunidades) son sensibles a las benzodiazepinas, existe una minoría de receptores GABA A (que contienen subunidades α 4 o α 6 ) que son insensibles a las 1,4-benzodiazepinas clásicas, [12] pero en cambio son sensibles a otras clases de fármacos GABAérgicos como los neuroesteroides y el alcohol. Además , existen receptores periféricos de benzodiazepinas que no están asociados con los receptores GABA A. Como resultado, la IUPHAR ha recomendado que los términos " receptor BZ ", " receptor GABA / BZ " y " receptor omega " ya no se utilicen y que el término " receptor de benzodiazepinas"sustituirse por" sitio de benzodiazepinas ". [13]
Para que los receptores GABA A sean sensibles a la acción de las benzodiazepinas, necesitan contener una subunidad α y una γ, entre las cuales se une la benzodiazepina. Una vez unida, la benzodiazepina bloquea el receptor GABA A en una conformación donde el neurotransmisor GABA tiene una afinidad mucho mayor por el receptor GABA A , lo que aumenta la frecuencia de apertura del canal de iones cloruro asociado e hiperpolariza la membrana. Esto potencia el efecto inhibidor del GABA disponible que conduce a efectos sedantes y ansiolíticos. [ cita requerida ]
Las diferentes benzodiazepinas tienen diferentes afinidades por los receptores GABA A formados por diferentes colecciones de subunidades, y esto significa que su perfil farmacológico varía con la selectividad del subtipo. Por ejemplo, los ligandos del receptor de benzodiazepinas con alta actividad en α 1 y / o α 5 tienden a estar más asociados con sedación , ataxia y amnesia , mientras que aquellos con mayor actividad en los receptores GABA A que contienen subunidades α 2 y / o α 3 generalmente tienen mayor actividad ansiolítica . [14] AnticonvulsivoLos agonistas que actúan en cualquiera de los subtipos de GABA A pueden producir efectos , pero la investigación actual en esta área se centra principalmente en la producción de agonistas selectivos α 2 como anticonvulsivos que carecen de los efectos secundarios de los fármacos más antiguos, como la sedación y la amnesia.
El sitio de unión de las benzodiazepinas es distinto del sitio de unión de los barbitúricos y GABA en el receptor GABA A , y también produce diferentes efectos sobre la unión, [15] con las benzodiazepinas aumentando la frecuencia de apertura del canal de cloruro, mientras que los barbitúricos aumentan la duración de la unión. apertura del canal de cloruro cuando se une GABA. [16] Dado que estos son efectos moduladores separados, ambos pueden tener lugar al mismo tiempo, por lo que la combinación de benzodiazepinas con barbitúricos es fuertemente sinérgica y puede ser peligrosa si la dosis no se controla estrictamente.
También tenga en cuenta que algunos agonistas de GABA A , como muscimol y gaboxadol , se unen al mismo sitio en el complejo del receptor GABA A que el propio GABA y, en consecuencia, producen efectos que son similares pero no idénticos a los de los moduladores alostéricos positivos como las benzodiazepinas. [ cita requerida ]
Estructura y función [ editar ]
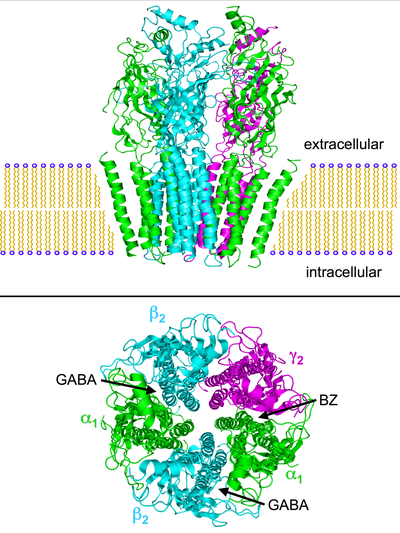
La comprensión estructural del receptor GABA A se basó inicialmente en modelos de homología, obtenidos utilizando estructuras cristalinas de proteínas homólogas como la proteína de unión a acetilcolina (AChBP) y los receptores nicotínicos de acetilcolina (nACh) como plantillas. [17] [18] [19] La estructura tan buscada de un receptor GABA A finalmente se resolvió, con la divulgación de la estructura cristalina del receptor GABA A homopentamérico β3 humano . [20] Si bien este fue un avance importante, la mayoría de GABA Alos receptores son heteroméricos y la estructura no proporcionó ningún detalle del sitio de unión de las benzodiazepinas. Esto fue finalmente aclarado en 2018 mediante la publicación de una estructura crio-EM de alta resolución del receptor α1β1γ2S de rata [21] y el receptor α1β2γ2 humano unido con GABA y la benzodiazepina neutra flumazenil. [22]
Los receptores GABA A son receptores transmembrana pentaméricos que constan de cinco subunidades dispuestas alrededor de un poro central . Cada subunidad comprende cuatro dominios transmembrana con los extremos N y C ubicados extracelularmente. El receptor se encuentra en la membrana de su neurona , generalmente localizada en una sinapsis , postsinápticamente. Sin embargo, algunas isoformas pueden encontrarse de forma extra sináptica. [23] Cuando las vesículasde GABA se liberan presinápticamente y activan los receptores GABA en la sinapsis, esto se conoce como inhibición fásica. Sin embargo, el GABA que se escapa de la hendidura sináptica puede activar receptores en las terminales presinápticas o en las sinapsis vecinas en la misma neurona o en neuronas adyacentes (un fenómeno denominado `` desbordamiento ''), además de que las concentraciones bajas y constantes de GABA en el espacio extracelular dan como resultado una activación persistente. de los receptores GABA A conocidos como inhibición tónica. [24]
El ligando GABA es el compuesto endógeno que hace que este receptor se abra; una vez unido a GABA, el receptor de proteína cambia de conformación dentro de la membrana, abriendo el poro para permitir que los aniones cloruro (Cl - ) y, en menor medida, los iones bicarbonato (HCO 3 - ) pasen por su gradiente electroquímico . El sitio de unión a GABA está a unos 80 Å de la parte más estrecha del canal iónico. Estudios computacionales recientes han sugerido un mecanismo alostérico por el cual la unión de GABA conduce a la apertura del canal iónico. [25] Porque el potencial de reversiónpara el cloruro en la mayoría de neuronas maduras está cerca de o más negativo que el de descanso potencial de membrana , la activación de GABA A receptores tiende a estabilizar o hyperpolarise el potencial de reposo, y puede hacer que sea más difícil para excitatorios neurotransmisores a despolarizan la neurona y generan un potencial de acción . Por lo tanto, el efecto neto es típicamente inhibitorio, reduciendo la actividad de la neurona, aunque se han observado corrientes despolarizantes en respuesta a GABA en neuronas inmaduras en el desarrollo temprano. Este efecto durante el desarrollo se debe a una Cl modificado - gradiente en el que los aniones salen de las células a través del GABA Areceptores, ya que su concentración de cloro intracelular es mayor que la extracelular. [26] Se presume que la diferencia en la concentración de aniones de cloro extracelular se debe a la mayor actividad de los transportadores de cloruro, como NKCC1 , que transportan el cloruro a las células que están presentes en las primeras etapas del desarrollo, mientras que, por ejemplo, KCC2 transporta el cloruro fuera de las células y es el factor dominante en el establecimiento del gradiente de cloruro más adelante en el desarrollo. Estos eventos de despolarización han demostrado ser clave en el desarrollo neuronal. [27] En la neurona madura, el canal GABA A se abre rápidamente y, por lo tanto, contribuye a la parte inicial del potencial inhibidor postsináptico (IPSP).[28] [29] El ligando endógeno que se une al sitio de las benzodiazepinas es la inosina . [30] [ cita requerida ]
Subunidades [ editar ]
Los receptores GABA A son miembros de la superfamilia de canales iónicos activados por ligandos relacionados evolutivamente y estructuralmente similares de canales iónicos activados por ligandos pentaméricos grandes (anteriormente denominados receptores de "bucle Cys ") que también incluye receptores nicotínicos de acetilcolina , receptores de glicina y el receptor 5HT 3 . Existen numerosas isoformas de subunidades para el receptor GABA A , que determinan la afinidad agonista del receptor, la posibilidad de apertura, la conductancia y otras propiedades. [31]
En los seres humanos, las unidades son las siguientes: [32]
- seis tipos de subunidades α ( GABRA1 , GABRA2 , GABRA3 , GABRA4 , GABRA5 , GABRA6 )
- tres βs ( GABRB1 , GABRB2 , GABRB3 )
- tres γs ( GABRG1 , GABRG2 , GABRG3 )
- así como un δ ( GABRD ), un ε ( GABRE ), un π ( GABRP ) y un θ ( GABRQ )
Hay tres unidades ρ ( GABRR1 , GABRR2 , GABRR3 ); sin embargo, estos no se ensamblan con las unidades clásicas de GABA A enumeradas anteriormente, [33] sino que se homooligomerizan para formar receptores GABA A -ρ (anteriormente clasificados como receptores GABA C , pero ahora esta nomenclatura se ha desaprobado [34] ).
Distribución [ editar ]
Los receptores GABA A son responsables de la mayoría de las actividades fisiológicas del GABA en el sistema nervioso central y los subtipos de receptores varían significativamente. La composición de las subunidades puede variar ampliamente entre las regiones y los subtipos pueden estar asociados con funciones específicas. El requisito mínimo para producir un canal iónico controlado por GABA es la inclusión de una subunidad α y una β. [35] El receptor GABA A más común es un pentámero que comprende dos α, dos β y un γ (α 2 β 2 γ). [32] En las propias neuronas, el tipo de subunidades del receptor GABA A y sus densidades pueden variar entre los cuerpos celulares y las dendritas . [36]Los receptores GABA A también se pueden encontrar en otros tejidos, incluyendo células de Leydig , placenta , células inmunes , hígado , placas de crecimiento óseo y varios otros tejidos endocrinos . La expresión de la subunidad varía entre el tejido "normal" y las neoplasias , ya que los receptores GABA A pueden influir en la proliferación celular . [37]
| Isoforma | Sináptico / Extrasináptico | Localización anatómica |
|---|---|---|
| α1β3γ2S | Ambos | Extendido |
| α2β3γ2S | Ambos | Extendido |
| α3β3γ2S | Ambos | Núcleo talámico reticular |
| α4β3γ2S | Ambos | Células de relevo talámico |
| α5β3γ2S | Ambos | Células piramidales del hipocampo |
| α6β3γ2S | Ambos | Células granulares cerebelosas |
| α1β2γ2S | Ambos | Extendido, más abundante |
| α4β3δ | Extrasináptico | Células de relevo talámico |
| α6β3δ | Extrasináptico | Células granulares cerebelosas |
| α1β2 | Extrasináptico | Extendido |
| α1β3 | Extrasináptico | Tálamo, hipotálamo |
| α1β2δ | Extrasináptico | Hipocampo |
| α4β2δ | Extrasináptico | Hipocampo |
| α3β3θ | Extrasináptico | Hipotálamo |
| α3β3ε | Extrasináptico | Hipotálamo |
Ligandos [ editar ]
Se ha descubierto que varios ligandos se unen a varios sitios en el complejo del receptor GABA A y lo modulan además del propio GABA. [ cual? ] Un ligando puede poseer una o más propiedades de los siguientes tipos. Desafortunadamente, la literatura a menudo no distingue estos tipos adecuadamente.
Tipos [ editar ]
- Agonistas y antagonistas ortostéricos : se unen al sitio principal del receptor (el sitio donde GABA normalmente se une, también denominado sitio "activo" u "ortostérico"). Los agonistas activan el receptor, lo que resulta en un aumento de Cl - conductancia. Los antagonistas, aunque no tienen ningún efecto por sí mismos, compiten con el GABA por la unión y, por lo tanto, inhiben su acción, lo que resulta en una disminución de la conductancia de Cl - .
- Moduladores alostéricos de primer orden : se unen a sitios alostéricos en el complejo receptor y lo afectan de manera positiva (PAM), negativa (NAM) o neutra / silenciosa (SAM), provocando un aumento o disminución de la eficiencia del sitio principal y, por tanto, una aumento o disminución de la conductancia de Cl - . Los SAM no afectan la conductancia, pero ocupan el sitio de unión.
- Moduladores de segundo orden : se unen a un sitio alostérico en el complejo receptor y modulan el efecto de los moduladores de primer orden.
- Bloqueadores de canales abiertos : prolongan la ocupación ligando-receptor, la cinética de activación y el flujo de iones Cl de una manera dependiente de la configuración de la subunidad y dependiente del estado de sensibilización. [39]
- Bloqueadores de canales no competitivos : se unen al poro central del complejo receptor o cerca de él y bloquean directamente la conductancia de Cl - a través del canal iónico.
Ejemplos [ editar ]
- Agonistas ortostéricos : GABA , gaboxadol , isoguvacina , muscimol , progabida , beta-alanina, [40] [41] taurina, [41] [40] ácido piperidina-4-sulfónico (agonista parcial).
- Antagonistas ortostéricos: bicuculina , gabazina .
- Moduladores positivos alostéricos: barbitúricos , benzodiazepinas , ciertos carbamatos (ex. Carisoprodol , meprobamato , lorbamate ,) thienodiazepines , alcohol ( etanol ), etomidato , glutetimida , kavalactonas , [42] meprobamato , quinazolinonas (ex. Metacualona , etaqualone , diproqualone ), neuroactivo esteroides , [43] niacina /niacinamida , [44] no benzodiazepinas (por ejemplo , zolpidem , eszopiclona ), propofol , estiripentol , [45] teanina , [ cita requerida ] ácido valerénico , anestésicos volátiles / inhalados , lantano , [46] y riluzol . [47]
- Moduladores alostéricos negativos: flumazenil , Ro15-4513 , sarmazenil , amentoflavona y zinc . [48]
- Agonistas alostéricos inversas: beta-carbolinas (ex. Harmina , Harmaline , tetrahidroharmina ).
- Moduladores de segundo orden: (-) - epigalocatequina ‐ 3 ‐ galato . [49]
- Bloqueadores de canales no competitivos: cicutoxina , enantotoxina , pentilentetrazol , picrotoxina [ cita requerida ] , tuyona y lindano .
Efectos [ editar ]
Los ligandos que contribuyen a la activación del receptor tienen típicamente propiedades ansiolíticas , anticonvulsivas , amnésicas , sedantes , hipnóticas , euforizantes y relajantes musculares . Algunos, como el muscimol y los medicamentos z, también pueden ser alucinógenos . [ cita requerida ] Los ligandos que disminuyen la activación del receptor generalmente tienen efectos opuestos, que incluyen ansiogénesis y convulsión . [ cita requerida ]Algunos de los moduladores alostéricos negativos selectivos de subtipo, como α 5 IA, se están investigando por sus efectos nootrópicos , así como tratamientos para los efectos secundarios no deseados de otros fármacos GABAérgicos. [50]
Drogas nuevas [ editar ]
Una propiedad útil de los muchos moduladores alostéricos de sitios de benzodiazepina es que pueden mostrar unión selectiva a subconjuntos particulares de receptores que comprenden subunidades específicas. Esto permite determinar qué combinaciones de subunidades del receptor GABA A son prevalentes en áreas específicas del cerebro y proporciona una pista sobre qué combinaciones de subunidades pueden ser responsables de los efectos conductuales de los fármacos que actúan en los receptores GABA A. Estos ligandos selectivos pueden tener ventajas farmacológicas porque pueden permitir la disociación de los efectos terapéuticos deseados de los efectos secundarios indeseables. [51] Son pocos los ligandos selectivos de subtipos que se han utilizado en la clínica hasta ahora, con la excepción del zolpidem, que es razonablemente selectivo para α 1, Pero varios compuestos más selectivos están en desarrollo tales como el α 3 fármaco selectivo adipiplon . Hay muchos ejemplos de compuestos selectivos de subtipo que se utilizan ampliamente en la investigación científica, que incluyen:
- CL-218,872 ( agonista altamente selectivo de α 1 )
- bretazenil (agonista parcial selectivo de subtipo)
- imidazenil y L-838,417 (ambos agonistas parciales en algunos subtipos, pero antagonistas débiles en otros)
- QH-ii-066 (agonista completo altamente selectivo para el subtipo α 5 )
- α 5 IA (agonista inverso selectivo para el subtipo α 5 )
- SL-651,498 (agonista completo en los subtipos α 2 y α 3 , y como agonista parcial en α 1 y α 5
- 3-acil-4-quinolonas: selectivo para α 1 sobre α 3 [52]
Reacciones paradójicas [ editar ]
Existen múltiples indicios de que las reacciones paradójicas sobre, por ejemplo, benzodiazepinas, barbitúricos, anestésicos inhalatorios , propofol , neuroesteroides y alcohol se asocian con desviaciones estructurales de los receptores GABA A. La combinación de las cinco subunidades del receptor (ver imágenes de arriba) puede alterarse de tal manera que, por ejemplo, la respuesta del receptor a GABA permanece sin cambios, pero la respuesta a una de las sustancias nombradas es dramáticamente diferente de la normal.
Se estima que alrededor del 2–3% de la población general puede sufrir trastornos emocionales graves debido a tales desviaciones de los receptores, y hasta un 20% padece trastornos moderados de este tipo. Generalmente se asume que las alteraciones del receptor se deben, al menos en parte, a desviaciones genéticas y también epigenéticas . Hay indicios de que este último puede desencadenarse, entre otros factores, por estrés social o agotamiento ocupacional . [53] [54] [55] [56]
Ver también [ editar ]
- 4-yodopropofol
- Receptor GABA
- Receptor GABA B
- Receptor GABA A -ρ
- Gefirina
- Receptor de glicina
- Moduladores alostéricos positivos del receptor GABA A
- Moduladores alostéricos negativos para el receptor GABA A
Referencias [ editar ]
- ↑ a b Richter L, de Graaf C, Sieghart W, Varagic Z, Mörzinger M, de Esch IJ, Ecker GF, Ernst M (marzo de 2012). "Los modelos de receptor de GABAA unidos a diazepam identifican nuevos ligandos del sitio de unión de las benzodiazepinas" . Biología química de la naturaleza . 8 (5): 455–464. doi : 10.1038 / nchembio.917 . PMC 3368153 . PMID 22446838 .
- ^ Campagna-Slater V, Weaver DF (enero de 2007). "Modelado molecular de la proteína del canal de iones GABAA". Revista de modelado y gráficos moleculares . 25 (5): 721–730. doi : 10.1016 / j.jmgm.2006.06.001 . PMID 16877018 .
- ^ Sancar F, Ericksen SS, Kucken AM, Teissére JA, Czajkowski C (enero de 2007). "Determinantes estructurales para la unión de zolpidem de alta afinidad a los receptores GABA-A" . Farmacología molecular . 71 (1): 38–46. doi : 10.1124 / mol.106.029595 . PMC 2583146 . PMID 17012619 .
- ^ El manual de Oxford sobre estrés, salud y afrontamiento . Folkman, Susan. Oxford: Prensa de la Universidad de Oxford. 2011. ISBN 978-0-19-537534-3. OCLC 540015689 .CS1 maint: otros ( enlace )
- ^ Kaila, K .; Voipio, J. (18 de noviembre de 1987). "Caída postsináptica del pH intracelular inducida por la conductancia de bicarbonato activado por GABA". Naturaleza . 330 (6144): 163-165. Código Bibliográfico : 1987Natur.330..163K . doi : 10.1038 / 330163a0 . ISSN 0028-0836 . PMID 3670401 . S2CID 4330077 .
- ^ Principios de la ciencia neuronal . Kandel, Eric R., Schwartz, James H. (James Harris), 1932-2006, Jessell, Thomas M., Siegelbaum, Steven, Hudspeth, A. James, Mack, Sarah (5ª ed.). Nueva York. ISBN 978-1-283-65624-5. OCLC 919404585 .CS1 maint: otros ( enlace )
- ^ Chua HC, Chebib M (2017). "Receptores GABA a y la diversidad en su estructura y farmacología". Receptores GABAA y la diversidad en su estructura y farmacología . Avances en farmacología. 79 . págs. 1-34. doi : 10.1016 / bs.apha.2017.03.003 . ISBN 978-0-12-810413-2. PMID 28528665 .
- ^ Santhakumar V, Wallner M, Otis TS (mayo de 2007). "El etanol actúa directamente sobre subtipos extrasinápticos de receptores GABAA para aumentar la inhibición tónica" . Alcohol . 41 (3): 211-221. doi : 10.1016 / j.alcohol.2007.04.011 . PMC 2040048 . PMID 17591544 .
- ^ Johnston GA (1996). "Farmacología del receptor GABAA". Farmacología y terapéutica . 69 (3): 173-198. doi : 10.1016 / 0163-7258 (95) 02043-8 . PMID 8783370 .
- ^ Sigel E (agosto de 2002). "Mapeo del sitio de reconocimiento de benzodiazepinas en receptores GABA (A)". Temas actuales en química medicinal . 2 (8): 833–839. doi : 10.2174 / 1568026023393444 . PMID 12171574 .
- ^ Akabas MH (2004). Estudios de estructura-función del receptor GABAA: un reexamen a la luz de las nuevas estructuras del receptor de acetilcolina . Revista Internacional de Neurobiología. 62 . págs. 1-43. doi : 10.1016 / S0074-7742 (04) 62001-0 . ISBN 978-0-12-366862-2. PMID 15530567 .
- ^ Derry JM, Dunn SM, Davies M (marzo de 2004). "Identificación de un residuo en la subunidad alfa del receptor de tipo A del ácido gamma-aminobutírico que afecta diferencialmente la unión al sitio de benzodiazepina sensible e insensible al diazepam" . Revista de neuroquímica . 88 (6): 1431-1438. doi : 10.1046 / j.1471-4159.2003.02264.x . PMID 15009644 .
- ^ Barnard EA, Skolnick P, Olsen RW, Mohler H, Sieghart W, Biggio G, Braestrup C, Bateson AN, Langer SZ (junio de 1998). "Unión Internacional de Farmacología. XV. Subtipos de receptores del ácido gamma-aminobutírico A: clasificación sobre la base de la estructura de la subunidad y la función del receptor" . Revisiones farmacológicas . 50 (2): 291–313. PMID 9647870 .
- ^ Atack JR (agosto de 2003). "Compuestos ansioselectivos que actúan en el sitio de unión de benzodiazepinas del receptor GABA (A)". Objetivos de fármacos actuales. Trastornos neurológicos y del SNC . 2 (4): 213–232. doi : 10.2174 / 1568007033482841 . PMID 12871032 .
- ^ Hanson SM, Czajkowski C (marzo de 2008). "Mecanismos estructurales subyacentes a la modulación de las benzodiazepinas del receptor GABA (A)" . La Revista de Neurociencia . 28 (13): 3490–3499. doi : 10.1523 / JNEUROSCI.5727-07.2008 . PMC 2410040 . PMID 18367615 .
- ^ Twyman RE, Rogers CJ, Macdonald RL (marzo de 1989). "Regulación diferencial de los canales del receptor del ácido gamma-aminobutírico por diazepam y fenobarbital". Annals of Neurology . 25 (3): 213–220. doi : 10.1002 / ana.410250302 . hdl : 2027,42 / 50330 . PMID 2471436 . S2CID 72023197 .
- ^ Ernst M, Bruckner S, Boresch S, Sieghart W (noviembre de 2005). "Modelos comparativos de dominios extracelulares y transmembrana del receptor GABAA: conocimientos importantes en farmacología y función" (PDF) . Farmacología molecular . 68 (5): 1291-1300. doi : 10.1124 / mol.105.015982 . PMID 16103045 . S2CID 15678338 .
- ^ Vijayan RS, Trivedi N, Roy SN, Bera I, Manoharan P, Payghan PV, Bhattacharyya D, Ghoshal N (noviembre de 2012). "Modelado de las conformaciones de estado abierto y cerrado del canal de iones GABA (A) - información estructural plausible para la compuerta del canal". Revista de información química y modelado . 52 (11): 2958-2969. doi : 10.1021 / ci300189a . PMID 23116339 .
- ^ Mokrab Y, Bavro V, Mizuguchi K, Todorov NP, Martin IL, Dunn SM, Chan SL, Chau PL (noviembre de 2007). "Explorando el reconocimiento de ligandos y el flujo de iones en modelos comparativos del receptor humano GABA tipo A". Revista de Modelado y Gráficos Moleculares . 26 (4): 760–774. doi : 10.1016 / j.jmgm.2007.04.012 .
- ^ Miller PS, Aricescu AR (agosto de 2014). "Estructura cristalina de un receptor GABAA humano" . Naturaleza . 512 (7514): 270–275. Código Bibliográfico : 2014Natur.512..270M . doi : 10.1038 / nature13293 . PMC 4167603 . PMID 24909990 .
- ↑ Phulera, Swastik; Zhu, Hongtao; Yu, Jie; Claxton, Derek P; Yoder, Nate; Yoshioka, Craig; Gouaux, Eric (25 de julio de 2018). "Estructura crio-EM del receptor GABAA tri-heteromérico α1β1γ2S sensible a las benzodiazepinas en complejo con GABA" . eLife . 7 : e39383. doi : 10.7554 / eLife.39383 . ISSN 2050-084X . PMC 6086659 . PMID 30044221 .
- ^ Zhu S, Noviello CM, Teng J, Walsh RM, Kim JJ, Hibbs RE (julio de 2018). "Estructura de un receptor GABA A sináptico humano " . Naturaleza . 559 (7712): 67–72. Código Bib : 2018Natur.559 ... 67Z . doi : 10.1038 / s41586-018-0255-3 . PMC 6220708 . PMID 29950725 .
- ^ Wei W, Zhang N, Peng Z, Houser CR, Mody I (noviembre de 2003). "Localización perisináptica de receptores GABA (A) que contienen subunidades delta y su activación por derrame de GABA en la circunvolución dentada del ratón" . La Revista de Neurociencia . 23 (33): 10650–10661. doi : 10.1523 / JNEUROSCI.23-33-10650.2003 . PMC 6740905 . PMID 14627650 .
- ^ Farrant, Mark; Nusser, Zoltan (marzo de 2005). "Variaciones sobre un tema inhibitorio: activación fásica y tónica de los receptores GABA (A)" . Reseñas de la naturaleza. Neurociencia . 6 (3): 215-229. doi : 10.1038 / nrn1625 . ISSN 1471-003X . PMID 15738957 .
- ^ Várnai C, Irwin BW, Payne MC, Csányi G, Chau PL (junio de 2020). "Movimientos funcionales del receptor GABA tipo A" . Física Química Física Química . 22 (28): 16023–16031. doi : 10.1039 / D0CP01128B . PMID 32633279 .
- ^ Ben-Ari Y, Cherubini E, Corradetti R, Gaiarsa JL (septiembre de 1989). "Potenciales sinápticos gigantes en neuronas del hipocampo CA3 de rata inmadura" . La revista de fisiología . 416 : 303–325. doi : 10.1113 / jphysiol.1989.sp017762 . PMC 1189216 . PMID 2575165 .
- ^ Spitzer NC (marzo de 2010). "Cómo GABA genera despolarización" . La revista de fisiología . 588 (Parte 5): 757–758. doi : 10.1113 / jphysiol.2009.183574 . PMC 2834934 . PMID 20194137 .
- ^ Olsen RW, DeLorey TM (1999). "Capítulo 16: GABA y glicina" . En Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD (eds.). Neuroquímica básica: aspectos moleculares, celulares y médicos (Sexta ed.). Filadelfia: Lippincott-Raven. ISBN 978-0-397-51820-3.
- ^ Chen K, Li HZ, Ye N, Zhang J, Wang JJ (octubre de 2005). "Papel de los receptores GABAB en GABA y la inhibición inducida por baclofeno de neuronas del núcleo interpuesto cerebeloso de rata adulta in vitro". Boletín de investigación del cerebro . 67 (4): 310–318. doi : 10.1016 / j.brainresbull.2005.07.004 . PMID 16182939 . S2CID 6433030 .
- ↑ Yarom M, Tang XW, Wu E, Carlson RG, Vander Velde D, Lee X, Wu J (1 de agosto de 2016). "Identificación de la inosina como modulador endógeno del sitio de unión de las benzodiazepinas de los receptores GABAA". Revista de Ciencias Biomédicas . 5 (4): 274–280. doi : 10.1007 / bf02255859 . PMID 9691220 .
- ^ Cossart R, Bernard C, Ben-Ari Y (febrero de 2005). "Múltiples facetas de las sinapsis y neuronas GABAérgicas: múltiples destinos de la señalización de GABA en epilepsias". Tendencias en neurociencias . 28 (2): 108-115. doi : 10.1016 / j.tins.2004.11.011 . PMID 15667934 . S2CID 1424286 .
- ^ a b Martin IL y Dunn SMJ. Receptores GABA Una revisión de GABA y los receptores a los que se une. Tocris Cookson LTD.
- ^ Enz R, Cutting GR (mayo de 1998). "Composición molecular de los receptores GABAC". Investigación de la visión . 38 (10): 1431-1441. doi : 10.1016 / S0042-6989 (97) 00277-0 . PMID 9667009 . S2CID 14457042 .
- ^ Olsen RW, Sieghart W (enero de 2009). "Receptores GABA A: los subtipos proporcionan diversidad de funciones y farmacología" . Neurofarmacología . 56 (1): 141-148. doi : 10.1016 / j.neuropharm.2008.07.045 . PMC 3525320 . PMID 18760291 .
- ^ Connolly CN, Krishek BJ, McDonald BJ, Smart TG, Moss SJ (enero de 1996). "Ensamblaje y expresión de la superficie celular de los receptores de tipo A del ácido gamma-aminobutírico heteroméricos y homoméricos" . La Revista de Química Biológica . 271 (1): 89–96. doi : 10.1074 / jbc.271.1.89 . PMID 8550630 .
- ^ Lorenzo LE, Russier M, Barbe A, Fritschy JM, Bras H (septiembre de 2007). "Organización diferencial del ácido gamma-aminobutírico tipo A y receptores de glicina en los compartimentos somáticos y dendríticos de las motoneuronas abducens de rata". La Revista de Neurología Comparada . 504 (2): 112–126. doi : 10.1002 / cne.21442 . PMID 17626281 .
- ↑ ten Hoeve AL (2012). Receptores GABA y sistema inmunológico . Tesis , Universidad de Utrecht
- ^ Mortensen M, Patel B, Smart TG (enero de 2011). "Potencia GABA en receptores GABA (A) encontrados en zonas sinápticas y extrainápticas" . Fronteras en neurociencia celular . 6 : 1. doi : 10.3389 / fncel.2012.00001 . PMC 3262152 . PMID 22319471 .
- ^ Haseneder R, Rammes G, Zieglgänsberger W, Kochs E, Hapfelmeier G (septiembre de 2002). "Activación del receptor GABA (A) y bloqueo de canales abiertos por anestésicos volátiles: ¿un nuevo principio de modulación del receptor?". Revista europea de farmacología . 451 (1): 43–50. doi : 10.1016 / S0014-2999 (02) 02194-5 . PMID 12223227 .
- ^ a b Mori, Masahiro; Gähwiler, Beat H; Gerber, Urs (15 de febrero de 2002). "β-alanina y taurina como agonistas endógenos en receptores de glicina en hipocampo de rata in vitro" . La revista de fisiología . 539 (Parte 1): 191–200. doi : 10.1113 / jphysiol.2001.013147 . ISSN 0022-3751 . PMC 2290126 . PMID 11850512 .
- ^ a b Horikoshi, T .; Asanuma, A .; Yanagisawa, K .; Anzai, K .; Goto, S. (septiembre de 1988). "La taurina y la beta-alanina actúan sobre los receptores de GABA y glicina en ovocitos de Xenopus inyectados con ARN mensajero de cerebro de ratón". Investigación del cerebro . 464 (2): 97-105. doi : 10.1016 / 0169-328x (88) 90002-2 . ISSN 0006-8993 . PMID 2464409 .
- ^ Hunter, A (2006). "Kava (Piper methysticum) de nuevo en circulación". Centro Australiano de Medicina Complementaria . 25 (7): 529.
- ↑ (a) Herd MB, Belelli D, Lambert JJ (octubre de 2007). "Modulación de neuroesteroides de receptores GABA (A) sinápticos y extrasinápticos" . Farmacología y terapéutica . 116 (1): 20–34. arXiv : 1607.02870 . doi : 10.1016 / j.pharmthera.2007.03.007 . PMID 17531325 . ; (b) Hosie AM, Wilkins ME, da Silva HM, Smart TG (noviembre de 2006). "Los neuroesteroides endógenos regulan los receptores GABAA a través de dos sitios transmembrana discretos". Naturaleza . 444 (7118): 486–489. Código bibliográfico : 2006Natur.444..486H . doi : 10.1038 / nature05324 . PMID 17108970 . S2CID 4382394 . ; (c) Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, Guidotti A (septiembre de 2006). "Caracterización de neuronas cerebrales que expresan enzimas que median la biosíntesis de neurosteroides" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (39): 14602-14607. Código Bibliográfico : 2006PNAS..10314602A . doi : 10.1073 / pnas.0606544103 . PMC 1600006 . PMID 16984997 . ; (d) Akk G, Shu HJ, Wang C, Steinbach JH, Zorumski CF, Covey DF, Mennerick S (diciembre de 2005). "Acceso de neuroesteroides al receptor GABAA" . La Revista de Neurociencia . 25 (50): 11605-11613. doi : 10.1523 / JNEUROSCI.4173-05.2005 . PMC 6726021 . PMID 16354918 . ; (e) Belelli D, Lambert JJ (julio de 2005). "Neuroesteroides: reguladores endógenos del receptor GABA (A)". Reseñas de la naturaleza. Neurociencia . 6 (7): 565–575. doi : 10.1038 / nrn1703 . PMID 15959466 . S2CID 12596378 . ; (f) Pinna G, Costa E, Guidotti A (junio de 2006). "La fluoxetina y la norfluoxetina aumentan de forma estereoespecífica y selectiva el contenido de neurosteroides cerebrales en dosis que son inactivas en la recaptación de 5-HT". Psicofarmacología . 186 (3): 362–372. doi : 10.1007 / s00213-005-0213-2 . PMID 16432684 . S2CID 7799814 . ; (g) Dubrovsky BO (febrero de 2005). "Esteroides, esteroides neuroactivos y neuroesteroides en psicopatología". Progreso en Neuro-Psicofarmacología y Psiquiatría Biológica . 29 (2): 169-192. doi : 10.1016 / j.pnpbp.2004.11.001 . PMID 15694225 . S2CID 36197603 . ; (h) Mellon SH, Griffin LD (2002). "Neuroesteroides: bioquímica y significado clínico". Tendencias en endocrinología y metabolismo . 13 (1): 35–43. doi : 10.1016 / S1043-2760 (01) 00503-3 . PMID 11750861 . S2CID 11605131 . ; (i) Puia G, Santi MR, Vicini S, Pritchett DB, Purdy RH, Paul SM, Seeburg PH, Costa E (mayo de 1990). "Los neuroesteroides actúan sobre los receptores GABAA humanos recombinantes". Neurona . 4 (5): 759–765. doi : 10.1016 / 0896-6273 (90) 90202-Q . PMID 2160838 . S2CID 12626366 . ; (j) Majewska MD, Harrison NL, Schwartz RD, Barker JL, Paul SM (mayo de 1986). "Los metabolitos de las hormonas esteroides son moduladores de tipo barbitúrico del receptor GABA" . Ciencia . 232 (4753): 1004–1007. Código Bibliográfico : 1986Sci ... 232.1004D . doi : 10.1126 / science.2422758 . PMID 2422758 . ; (k) Reddy DS, Rogawski MA (2012). "Neuroesteroides - reguladores endógenos de susceptibilidad a las convulsiones y papel en el tratamiento de la epilepsia" . En Noebels JL, Avoli M, Rogawski MA, et al. (eds.). Mecanismos básicos de las epilepsias de Jasper [Internet]. 4ª edición. Bethesda (MD): Centro Nacional de Información Biotecnológica (EE . UU . ) . Centro Nacional de Información Biotecnológica (EE. UU.).
- ^ Toraskar, Mrunmayee; Pratima RP Singh; Shashank Neve (2010). "ESTUDIO DE AGONISTAS GABAÉRGICOS" (PDF) . Deccan Journal of Pharmacology . 1 (2): 56–69. Archivado desde el original (PDF) el 16 de octubre de 2013 . Consultado el 12 de febrero de 2013 .
- ^ Fisher JL (enero de 2009). "El estiripentol anticonvulsivo actúa directamente sobre el receptor GABA (A) como modulador alostérico positivo" . Neurofarmacología . 56 (1): 190-197. doi : 10.1016 / j.neuropharm.2008.06.004 . PMC 2665930 . PMID 18585399 .
- ^ Boldyreva AA (octubre de 2005). "El lantano potencia las corrientes activadas por GABA en neuronas piramidales de rata del campo hipocampal CA1". Boletín de Biología y Medicina Experimental . 140 (4): 403–405. doi : 10.1007 / s10517-005-0503-z . PMID 16671565 . S2CID 13179025 .
- ^ He Y, Benz A, Fu T, Wang M, Covey DF, Zorumski CF, Mennerick S (febrero de 2002). "El agente neuroprotector riluzol potencia la función del receptor postsináptico GABA (A)". Neurofarmacología . 42 (2): 199-209. doi : 10.1016 / s0028-3908 (01) 00175-7 . PMID 11804616 . S2CID 24194421 .
- ^ Hosie AM, Dunne EL, Harvey RJ, Smart TG (abril de 2003). "Inhibición mediada por zinc de los receptores GABA (A): los sitios de unión discretos subyacen a la especificidad del subtipo". Neurociencia de la naturaleza . 6 (4): 362–369. doi : 10.1038 / nn1030 . PMID 12640458 . S2CID 24096465 .
- ^ Campbell, Erica L .; Chebib, Mary; Johnston, Graham AR (15 de octubre de 2004). "Los flavonoides dietéticos apigenina y (-) - galato de epigalocatequina potencian la modulación positiva por diazepam de la activación por GABA de receptores GABAA recombinantes" . Farmacología bioquímica . Seis décadas de GABA. 68 (8): 1631–1638. doi : 10.1016 / j.bcp.2004.07.022 . ISSN 0006-2952 .
- ^ Dawson GR, Maubach KA, Collinson N, Cobain M, Everitt BJ, MacLeod AM, Choudhury HI, McDonald LM, Pillai G, Rycroft W, Smith AJ, Sternfeld F, Tattersall FD, Wafford KA, Reynolds DS, Seabrook GR, Atack JR (marzo de 2006). "Un agonista inverso selectivo para los receptores GABAA que contienen subunidades alfa5 mejora la cognición" (PDF) . La Revista de Farmacología y Terapéutica Experimental . 316 (3): 1335-1345. doi : 10.1124 / jpet.105.092320 . PMID 16326923 . S2CID 6410599 .
- ^ Da Settimo F, Taliani S, Trincavelli ML, Montali M, Martini C (2007). "Subtipos de receptores GABA A / Bz como dianas para fármacos selectivos". Química Medicinal Actual . 14 (25): 2680–2701. doi : 10.2174 / 092986707782023190 . PMID 17979718 .
- ^ Lager E, Nilsson J, Østergaard Nielsen E, Nielsen M, Liljefors T, Sterner O (julio de 2008). "Afinidad de 4-quinolonas sustituidas con 3-acilo en el sitio de las benzodiazepinas de los receptores GABA (A)". Química bioorgánica y medicinal . 16 (14): 6936–6948. doi : 10.1016 / j.bmc.2008.05.049 . PMID 18541432 .
- ^ Robin C, Trieger N (2002). "Reacciones paradójicas a las benzodiacepinas en la sedación intravenosa: reporte de 2 casos y revisión de la literatura" . Prog . De anestesia 49 (4): 128-132. PMC 2007411 . PMID 12779114 .
- ^ Paton, Carol (2002). "Benzodiazepinas y desinhibición: una revisión" . Boletín psiquiátrico . Real Colegio de Psiquiatras. 26 (12): 460–462. doi : 10.1192 / pb.26.12.460 . ISSN 0955-6036 . PDF .
- ^ Bäckström, T .; Bixo, M .; Johansson, M .; Nyberg, S .; Ossewaarde, L .; Ragagnin, G .; Savic, I .; Strömberg, J .; Timby, E .; van Broekhoven, F .; van Wingen, G. (febrero de 2014). "Alopregnanolona y trastornos del estado de ánimo". Progresos en neurobiología . 113 : 88–94. doi : 10.1016 / j.pneurobio.2013.07.005 . PMID 23978486 . S2CID 207407084 .
- ↑ Brown, Emery N .; Lydic, Ralph; Schiff, Nicholas D. (30 de diciembre de 2010). Schwartz, Robert S. (ed.). "Anestesia general, sueño y coma" . Revista de Medicina de Nueva Inglaterra . 363 (27): 2638–2650. doi : 10.1056 / NEJMra0808281 . ISSN 0028-4793 . PMC 3162622 . PMID 21190458 .
Lectura adicional [ editar ]
- Olsen RW, DeLorey TM (1999). "Capítulo 16: GABA y glicina" . En Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD (eds.). Neuroquímica básica: aspectos moleculares, celulares y médicos (Sexta ed.). Filadelfia: Lippincott-Raven. ISBN 978-0-397-51820-3.
- Olsen RW, Betz H (2005). "Capítulo 16: GABA y glicina". En Siegel GJ, Albers RW, Brady S, Price DD (eds.). Neuroquímica básica: aspectos moleculares, celulares y médicos (Séptima ed.). Boston: Prensa académica. págs. 291-302. ISBN 978-0-12-088397-4.
- Uusi-Oukari M, Korpi ER (marzo de 2010). "Regulación de la expresión de la subunidad del receptor GABA (A) por agentes farmacológicos" (PDF) . Revisiones farmacológicas . 62 (1): 97-135. doi : 10.1124 / pr.109.002063 . PMID 20123953 . S2CID 12202117 .
- Rudolph U (2015). Diversidad y funciones de los receptores GABA: un tributo a Hanns Möhler (Primera ed.). Prensa académica, Elsevier. ISBN 978-0-12-802660-1.
Enlaces externos [ editar ]
- Receptores, + GABA-A en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .