Proceso cumeno
El proceso cumeno ( proceso cumeno-fenol , proceso Hock ) es un proceso industrial para sintetizar fenol y acetona a partir de benceno y propileno . El término proviene de cumeno (isopropil benceno), el material intermedio durante el proceso. Fue inventado por R. Ūdris y P. Sergeyev en 1942 (URSS)., [1] e independientemente por Heinrich Hock en 1944 [2] [3]
Este proceso convierte dos materiales de partida relativamente baratos, benceno y propileno , en dos más valiosos, fenol y acetona . Otros reactivos requeridos son oxígeno del aire y pequeñas cantidades de un iniciador de radicales . La mayor parte de la producción mundial de fenol y acetona se basa ahora en este método. En 2003, se produjeron casi 7 millones de toneladas de fenol mediante el proceso de cumeno. [4] Para que este proceso sea económico, también debe haber demanda del subproducto de acetona , así como del fenol . [5]
Pasos del proceso
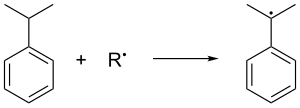
El cumeno se forma en la alquilación de Friedel-Crafts en fase gaseosa del benceno por el propeno. El benceno y el propeno se comprimen juntos a una presión de 30 atmósferas estándar a 250 ° C en presencia de un ácido de Lewis catalítico . El ácido fosfórico se prefiere a menudo a los haluros de aluminio . El cumeno se oxida en el aire, lo que elimina el hidrógeno bencílico terciario del cumeno y, por lo tanto, forma un radical cumeno :
Luego, el radical cumeno se une con una molécula de oxígeno para dar un radical peróxido de cumeno , que a su vez forma hidroperóxido de cumeno (C 6 H 5 C (CH 3 ) 2 O 2 H) mediante la abstracción de un hidrógeno bencílico de otra molécula de cumeno. Este último cumeno se convierte en radical cumeno y se retroalimenta en formaciones de cadena posteriores de hidroperóxidos de cumeno. Se utiliza una presión de 5 atm para garantizar que el peróxido inestable se mantenga en estado líquido.
El hidroperóxido de cumeno se hidroliza luego en un medio ácido (la transposición de Hock ) para dar fenol y acetona . En el primer paso, se protona el átomo de oxígeno hidroperoxi terminal. A esto le sigue un paso en el que el grupo fenilo migra del carbono bencilo al oxígeno adyacente y se pierde una molécula de agua, produciendo un carbocatión terciario estabilizado por resonancia . El mecanismo concertado de este paso es similar a los mecanismos de oxidación de Baeyer-Villiger [6] y también al paso de oxidación de hidroboración-oxidación . [7] En 2009, un acidificadoSe demostró que la arcilla de bentonita es un catalizador más económico que el ácido sulfúrico como medio ácido.
Como se muestra a continuación, el carbocatión resultante es atacado por el agua, luego se transfiere un protón del oxígeno hidroxi al oxígeno del éter, y finalmente el ion se descompone en fenol y acetona.
Reacciones y modificaciones relacionadas
Alternativas a la coproducción de acetona
El ciclohexilbenceno puede reemplazar al isopropilbenceno. A través de la transposición de Hock, el hidroperóxido de ciclohexilbenceno se escinde para dar fenol y ciclohexanona . La ciclohexanona es un precursor importante de algunas medias de nailon . [8]
Comenzando con la alquilación del benceno con una mezcla de 1 y 2-butenos , el proceso de cumeno produce fenol y butanonas . [5]
Alternativas a la producción de fenol
- La hidroquinona se prepara mediante dialquilación de benceno con propeno para dar 1,4-diisopropilbenceno . Este compuesto reacciona con el aire para producir el bis (hidroperóxido). De manera análoga al comportamiento del hidroperóxido de cumeno , se reorganiza en ácido para dar acetona e hidroquinona. La oxidación de la hidroquinona da 1,4-benzoquinona: [9]
- C 6 H 4 (CHMe 2 ) 2 + 2.5 O 2 → C 6 H 4 O 2 + 2 OCMe 2 + H 2 O
- El resorcinol se prepara de forma análoga convirtiendo el 1,3-diisopropilbenceno en el bis (hidroperóxido), que se fragmenta en resorcinol y acetona. [10]
- El 2-naftol también se puede producir mediante un método análogo al proceso de cumeno. [11]
- El 3-clorofenol , que no surge de la cloración del fenol, se puede producir mediante el proceso de cumeno comenzando con la alquilación del clorobenceno con propileno. [12]
- Los cresoles se producen a partir de isopropiltolueno. [13]
Procesamiento de acetona
La acetona bruta se hidrogena en fase líquida sobre níquel Raney o una mezcla de óxido de cobre y cromo para dar alcohol isopropílico . Este proceso es útil cuando se combina con un exceso de producción de acetona. [14] [1]
Mitsui & Co. desarrolló pasos adicionales para hidrogenar acetona y deshidrogenar el producto de isopropanol a propeno, que se recicla como reactivo de partida. [5]
Ver también
- El bisfenol A
- Proceso de Dow
- Alquilación de Friedel Crafts
- Oxidación de Baeyer-Villiger
- Proceso Raschig-Hooker (también produce fenol)
Referencias
- ^ http://izgudrojumi.lza.lv/izg_en.php?id=54
- ↑ Hock, H. y Lang, S. (1944), Autoxydation von Kohlenwasserstoffen, IX. Mitteil .: Über Peroxyde von Benzol-Derivaten. Berichte der deutschen chemischen Gesellschaft (Series A y B), 77: 257–264 doi : 10.1002 / cber.19440770321
- ^ Química de la enciclopedia concisa (1993) Mary Eagleso
- ^ Manfred Weber, Markus Weber, Michael Kleine-Boymann "Fenol" en la Enciclopedia de Química Industrial 2004 de Ullmann, Wiley-VCH. doi : 10.1002 / 14356007.a19_299.pub2 .
- ^ a b c "Rutas directas al fenol" . Archivado desde el original el 9 de abril de 2007 . Consultado el 26 de diciembre de 2006 .
- ^ Streitwieser, A; Heathcock, CH (1992). "30" . Introducción a la química orgánica . Kosower, EM (4ª ed.). Nueva York: MacMillan. págs. 1018 . ISBN 0-02-418170-6.
- ^ KPC, Vollhardt; NE Schore (2003). "22" . Química orgánica: estructura y función (4ª ed.). Nueva York: Freeman. pag. 988. ISBN 0-7167-4374-4.
- ↑ Plotkin, Jeffrey S. (21 de marzo de 2016). "¿Qué hay de nuevo en la producción de fenol?" . Sociedad Química Americana. Archivado desde el original el 27 de octubre de 2019 . Consultado el 2 de enero de 2018 .
- ^ Gerhard Franz, Roger A. Sheldon "Oxidación" en Enciclopedia de química industrial de Ullmann , Wiley-VCH, Weinheim, 2000 doi : 10.1002 / 14356007.a18_261
- ^ KW Schmiedel, D. Decker (2012). "Resorcinol". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a23_111.pub2 .Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Gerald Booth "Derivados de naftaleno" en Enciclopedia de química industrial de Ullmann, 2005, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a17_009 .
- ^ François Muller, Liliane Caillard (2011). "Clorofenoles". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a07_001.pub2 .Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Roger A. Sheldon (1983). Patai, Saul (ed.). Síntesis y usos de hidroperóxidos y dialquilperóxidos . Química de grupos funcionales de PATAI. John Wiley e hijos. doi : 10.1002 / 9780470771730.ch6 .
- ^ Papá, AJ "Propanols". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a22_173 .
enlaces externos
- Fenol: la industria química esencial en línea
| Wikimedia Commons tiene medios relacionados con el proceso Cumene . |
- Procesos quimicos