En química , la hibridación orbital (o hibridación ) es el concepto de mezclar orbitales atómicos en nuevos orbitales híbridos (con diferentes energías, formas, etc., que los orbitales atómicos componentes) adecuados para el emparejamiento de electrones para formar enlaces químicos en la teoría de enlaces de valencia. . Por ejemplo, en un átomo de carbono que forma cuatro enlaces sencillos, el orbital de la capa de valencia se combina con tres orbitales p de la capa de valencia para formar cuatro mezclas sp 3 equivalentes que están dispuestas en una disposición tetraédrica alrededor del carbono para unirse a cuatro átomos diferentes. Los orbitales híbridos son útiles en la explicación degeometría molecular y propiedades de enlace atómico y están dispuestos simétricamente en el espacio. Por lo general, los orbitales híbridos se forman mezclando orbitales atómicos de energías comparables. [1]
Historia y usos
El químico Linus Pauling desarrolló por primera vez la teoría de la hibridación en 1931 para explicar la estructura de moléculas simples como el metano (CH 4 ) utilizando orbitales atómicos . [2] Pauling señaló que un átomo de carbono forma cuatro enlaces usando un orbital sy tres orbitales p, de modo que "podría inferirse" que un átomo de carbono formaría tres enlaces en ángulos rectos (usando orbitales p) y un cuarto más débil enlace usando el orbital s en alguna dirección arbitraria. En realidad, el metano tiene cuatro enlaces CH de fuerza equivalente. El ángulo entre dos enlaces cualesquiera es el ángulo de enlace tetraédrico de 109 ° 28 ' [3](aprox. 109,5 °). Pauling supuso que en presencia de cuatro átomos de hidrógeno, los orbitales syp forman cuatro combinaciones equivalentes a las que llamó orbitales híbridos . Cada híbrido se denota sp 3 para indicar su composición y se dirige a lo largo de uno de los cuatro enlaces CH. [4] Este concepto fue desarrollado para sistemas químicos tan simples, pero el enfoque se aplicó más tarde y hoy se considera una heurística eficaz para racionalizar las estructuras de los compuestos orgánicos . Proporciona una imagen orbital simple equivalente a las estructuras de Lewis .
La teoría de la hibridación es una parte integral de la química orgánica , siendo uno de los ejemplos más convincentes las reglas de Baldwin . Para dibujar los mecanismos de reacción, a veces se necesita una imagen de enlace clásica con dos átomos que comparten dos electrones. [5] La teoría de la hibridación explica la unión en alquenos [6] y metano. [7] La cantidad de carácter p o s, que se decide principalmente por hibridación orbital, se puede utilizar para predecir de forma fiable propiedades moleculares como la acidez o la basicidad. [8]
Resumen
Los orbitales son una representación modelo del comportamiento de los electrones dentro de las moléculas. En el caso de la hibridación simple, esta aproximación se basa en orbitales atómicos , similares a los obtenidos para el átomo de hidrógeno, único átomo neutro para el que se puede resolver con exactitud la ecuación de Schrödinger . En los átomos más pesados, como el carbono, el nitrógeno y el oxígeno, los orbitales atómicos utilizados son los orbitales 2s y 2p, similares a los orbitales en estado excitado del hidrógeno.
Se supone que los orbitales híbridos son mezclas de orbitales atómicos, superpuestos entre sí en diversas proporciones. Por ejemplo, en el metano , el orbital híbrido C que forma cada enlace carbono - hidrógeno consta de un 25% de carácter s y un 75% de carácter p y, por lo tanto, se describe como sp 3 (leído como sp-tres ) hibridado. La mecánica cuántica describe este híbrido como una función de onda sp 3 de la forma N (s + √ 3 pσ), donde N es una constante de normalización (aquí 1/2) y pσ es un orbital ap dirigido a lo largo del eje CH para formar un enlace sigma. La relación de coeficientes (denotada como λ en general) es √ 3 en este ejemplo. Dado que la densidad de electrones asociada con un orbital es proporcional al cuadrado de la función de onda, la relación entre el carácter p y el carácter s es λ 2 = 3. El carácter p o el peso del componente p es N 2 λ 2 = 3 / 4.
Tipos de hibridación
sp 3

La hibridación describe la unión de átomos desde el punto de vista de un átomo. Para un carbono coordinado tetraédricamente (por ejemplo, metano CH 4 ), el carbono debe tener 4 orbitales con la simetría correcta para unirse a los 4 átomos de hidrógeno.
La configuración del estado fundamental del carbono es 1s 2 2s 2 2p 2 o más fácil de leer:
| C | ↑ ↓ | ↑ ↓ | ↑ | ↑ | |
| 1 s | 2 s | 2p | 2p | 2p |
El átomo de carbono puede usar sus dos orbitales de tipo p ocupados individualmente, para formar dos enlaces covalentes con dos átomos de hidrógeno, produciendo el metileno singlete CH 2 , el carbeno más simple . El átomo de carbono también puede unirse a cuatro átomos de hidrógeno mediante una excitación (o promoción) de un electrón desde el orbital 2s doblemente ocupado al orbital 2p vacío, produciendo cuatro orbitales ocupados individualmente.
| C* | ↑ ↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | 2 s | 2p | 2p | 2p |
La energía liberada por la formación de dos enlaces adicionales compensa con creces la energía de excitación requerida, favoreciendo energéticamente la formación de cuatro enlaces CH.
Mecánicamente cuántica, la energía más baja se obtiene si los cuatro enlaces son equivalentes, lo que requiere que se formen a partir de orbitales equivalentes en el carbono. Se puede obtener un conjunto de cuatro orbitales equivalentes que son combinaciones lineales de la capa de valencia (los orbitales centrales casi nunca están involucrados en la unión) sy funciones de onda p, [9] que son los cuatro híbridos sp 3 .
| C* | ↑ ↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | sp 3 | sp 3 | sp 3 | sp 3 |
En CH 4 , cuatro orbitales híbridos sp 3 se superponen con orbitales 1s de hidrógeno , produciendo cuatro enlaces σ (sigma) (es decir, cuatro enlaces covalentes simples) de igual longitud y fuerza.
 se traduce como
se traduce como 
sp 2


Otros compuestos de carbono y otras moléculas pueden explicarse de manera similar. Por ejemplo, el eteno (C 2 H 4 ) tiene un doble enlace entre los carbonos.
Para esta molécula, el carbono sp 2 se hibrida, porque se requiere un enlace π (pi) para el doble enlace entre los carbonos y solo se forman tres enlaces σ por átomo de carbono. En la hibridación sp 2, el orbital 2s se mezcla con solo dos de los tres orbitales 2p disponibles, generalmente denominados 2p x y 2p y . El tercer orbital 2p (2p z ) permanece sin hibridar.
| C* | ↑ ↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | sp 2 | sp 2 | sp 2 | 2p |
formando un total de tres orbitales sp 2 con un orbital p restante. En el etileno ( eteno ) los dos átomos de carbono forman un enlace σ superponiendo un orbital sp 2 de cada átomo de carbono. El enlace π entre los átomos de carbono perpendicular al plano molecular está formado por una superposición 2p – 2p. Cada átomo de carbono forma enlaces C – H covalentes con dos hidrógenos por superposición s – sp 2 , todos con ángulos de enlace de 120 °. Los enlaces hidrógeno-carbono son todos de igual fuerza y longitud, de acuerdo con los datos experimentales.
sp

El enlace químico en compuestos como los alquinos con triples enlaces se explica por la hibridación sp. En este modelo, el orbital 2s se mezcla con solo uno de los tres orbitales p,
| C* | ↑ ↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | sp | sp | 2p | 2p |
resultando en dos orbitales sp y dos orbitales p restantes. El enlace químico en acetileno (etino) (C 2 H 2 ) consiste en una superposición sp – sp entre los dos átomos de carbono que forman un enlace σ y dos enlaces π adicionales formados por una superposición p – p. Cada carbono también se une al hidrógeno en una superposición σ s – sp en ángulos de 180 °.
Hibridación y forma de la molécula

La hibridación ayuda a explicar la forma de la molécula , ya que los ángulos entre los enlaces son aproximadamente iguales a los ángulos entre los orbitales híbridos. Esto contrasta con la teoría de repulsión de pares de electrones de capa de valencia (RPECV) , que se puede utilizar para predecir la geometría molecular basada en reglas empíricas en lugar de en teorías orbitales o de enlace de valencia. [10]
hibridación sp x
Como los orbitales de valencia de los elementos del grupo principal son los orbitales uno sy tres p con la regla del octeto correspondiente , se utiliza la hibridación sp x para modelar la forma de estas moléculas.
| Número de coordinación | Forma | Hibridación | Ejemplos de |
|---|---|---|---|
| 2 | Lineal | hibridación sp (180 °) | CO 2 |
| 3 | Trigonal plana | hibridación sp 2 (120 °) | BCl 3 |
| 4 | Tetraédrico | hibridación sp 3 (109,5 °) | CCl 4 |
| Ángulos interorbitales [11] | |||
hibridación sp x d y
Como los orbitales de valencia de los metales de transición son los orbitales de cinco d, uno sy tres p con la correspondiente regla de 18 electrones , se utiliza la hibridación sp x d y para modelar la forma de estas moléculas. Estas moléculas tienden a tener múltiples formas correspondientes a la misma hibridación debido a los diferentes orbitales d involucrados. Un complejo plano cuadrado tiene un orbital p desocupado y, por lo tanto, tiene 16 electrones de valencia. [12]
| Número de coordinación | Forma | Hibridación | Ejemplos de |
|---|---|---|---|
| 4 | Plano cuadrado | hibridación sp 2 d | PtCl 4 2− |
| 5 | Triangular bipiramidal | hibridación sp 3 d | Fe (CO) 5 |
| Piramidal cuadrada | MnCl 5 2− | ||
| 6 | Octaédrico | hibridación sp 3 d 2 | Mes (CO) 6 |
| 7 | Bipiramidal pentagonal | sp 3 d 3 hibridación | ZrF 7 3− |
| Octaédrico coronado | MoF 7 - | ||
| Prismático trigonal tapado | TaF 7 2− | ||
| 8 | Antipismático cuadrado | sp 3 d 4 hibridación | ReF 8 - |
| Dodecaédrico | Mes (CN) 8 4− | ||
| Prismático trigonal bicapado | ZrF 8 4− | ||
| 9 | Prismático trigonal tricapado | sp 3 d 5 hibridación | ReH 9 2− |
| Antipismático cuadrado tapado |
hibridación sd x
En ciertos complejos de metales de transición con un recuento bajo de electrones d , los orbitales p están desocupados y se usa la hibridación sd x para modelar la forma de estas moléculas. [11] [13] [12]
| Número de coordinación | Forma | Hibridación | Ejemplos de |
|---|---|---|---|
| 3 | Piramidal trigonal | hibridación sd 2 (90 °) | CrO 3 |
| 4 | Tetraédrico | hibridación sd 3 (70,5 °, 109,5 °) | TiCl 4 |
| 5 | Piramidal cuadrada | hibridación sd 4 (65,9 °, 114,1 °) | Ta (CH 3 ) 5 |
| 6 | C 3v Trigonal prismático | hibridación sd 5 (63,4 °, 116,6 °) | W (canal 3 ) 6 |
| Ángulos interorbitales [11] | |||
Hibridación de moléculas hipervalentes
Expansión de octetos
En algunos libros de texto de química general, la hibridación se presenta para la coordinación del grupo principal número 5 y superior utilizando un esquema de "octeto expandido" con orbitales d propuestos por primera vez por Pauling. Sin embargo, este esquema ahora se considera incorrecto a la luz de los cálculos de la química computacional.
| Número de coordinación | Forma | Hibridación | Ejemplos de |
|---|---|---|---|
| 5 | Triangular bipiramidal | hibridación sp 3 d | PF 5 |
| 6 | Octaédrico | hibridación sp 3 d 2 | SF 6 |
| 7 | Bipiramidal pentagonal | sp 3 d 3 hibridación | SI 7 |
En 1990, Eric Alfred Magnusson de la Universidad de Nueva Gales del Sur publicó un artículo que excluía definitivamente el papel de la hibridación d-orbital en la unión en compuestos hipervalentes de elementos de la segunda fila ( período 3 ), poniendo fin a un punto de discordia y confusión. Parte de la confusión se origina en el hecho de que las funciones d son esenciales en los conjuntos de bases utilizados para describir estos compuestos (o de lo contrario resultan energías irrazonablemente altas y geometrías distorsionadas). Además, la contribución de la función d a la función de onda molecular es grande. Estos hechos se interpretaron incorrectamente en el sentido de que los orbitales d deben participar en la vinculación. [14] [15]
Resonancia
A la luz de la química computacional , un mejor tratamiento sería invocar la resonancia de enlace sigma además de la hibridación, lo que implica que cada estructura de resonancia tiene su propio esquema de hibridación. Todas las estructuras de resonancia deben obedecer la regla del octeto . [dieciséis]
| Número de coordinación | Estructuras de resonancia |
|---|---|
| 5 | Triangular bipiramidal |
 | |
| 6 | Octaédrico |
 | |
| 7 | Bipiramidal pentagonal |
 |
Hibridación isovalente
Aunque los orbitales híbridos ideales pueden ser útiles, en realidad, la mayoría de los enlaces requieren orbitales de carácter intermedio. Esto requiere una extensión para incluir ponderaciones flexibles de orbitales atómicos de cada tipo (s, p, d) y permite una descripción cuantitativa de la formación del enlace cuando la geometría molecular se desvía de los ángulos de enlace ideales. La cantidad de caracteres p no está restringida a valores enteros; es decir, también se describen fácilmente hibridaciones como sp 2.5 .
La hibridación de los orbitales de enlace está determinada por la regla de Bent : "El carácter atómico se concentra en orbitales dirigidos hacia sustituyentes electropositivos".
Moléculas con pares solitarios
Para moléculas con pares solitarios, los orbitales de enlace son híbridos sp x isovalentes . Por ejemplo, los dos orbitales híbridos de oxígeno en agua que forman enlaces pueden describirse como sp 4.0 para dar el ángulo interorbital de 104.5 °. [17] Esto significa que tienen un 20% de carácter s y un 80% de carácter p y no implica que un orbital híbrido se forme a partir de un orbital sy cuatro orbitales p en el oxígeno, ya que la subcapa 2p de oxígeno solo contiene tres orbitales p. Las formas de moléculas con pares solitarios son:
- Piramidal trigonal
- Tres híbridos de enlace isovalente (> 90 °)
- Por ejemplo, NH 3
- Doblado
- Dos híbridos de enlace isovalente (> 90 °)
- Por ejemplo, SO 2 , H 2 O
En tales casos, hay dos formas matemáticamente equivalentes de representar pares solitarios. Pueden estar representados por orbitales de simetría sigma y pi similares a la teoría de orbitales moleculares o por orbitales equivalentes similares a la teoría de VSEPR.
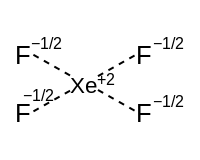
Moléculas hipervalentes
Para moléculas hipervalentes con pares solitarios, el esquema de enlace se puede dividir en un componente hipervalente y un componente que consta de híbridos de enlace sp x isovalentes . El componente hipervalente consiste en enlaces resonantes que utilizan orbitales p. La siguiente tabla muestra cómo se relaciona cada forma con los dos componentes y sus respectivas descripciones.
| Número de híbridos de enlaces isovalentes (marcados en rojo) | ||||
|---|---|---|---|---|
| Dos | Uno | - | ||
| Componente hipervalente [16] | Eje lineal (un orbital p) | Balancín | En forma de T | Lineal |
 |  |  | ||
| Ecuador plano cuadrado (dos orbitales p) | Piramidal cuadrada | Plano cuadrado | ||
 |  | |||
| Ecuador planar pentagonal (dos orbitales p) | Piramidal pentagonal | Plano pentagonal | ||
 |  | |||
Defectos de hibridación
La hibridación de los orbitales syp para formar híbridos sp x efectivos requiere que tengan una extensión radial comparable. Mientras que los orbitales 2p son en promedio menos del 10% más grandes que 2s, en parte atribuible a la falta de un nodo radial en los orbitales 2p, los orbitales 3p que tienen un nodo radial exceden los orbitales 3s en un 20-33%. [18] La diferencia en la extensión de los orbitales syp aumenta más abajo en un grupo. La hibridación de átomos en enlaces químicos se puede analizar considerando orbitales moleculares localizados, por ejemplo, utilizando orbitales moleculares localizados naturales en un esquema de orbitales de enlace natural (NBO). En el metano , CH 4 , la relación p / s calculada es aproximadamente 3 consistente con sp 3 "ideal"hibridación, mientras que para el silano , SiH 4 , la relación p / s está más cerca de 2. Se observa una tendencia similar para los otros elementos 2p. La sustitución de hidrógeno por flúor reduce aún más la relación p / s. [19] Los elementos 2p exhiben una hibridación casi ideal con orbitales híbridos ortogonales. Para elementos de bloque p más pesados, esta suposición de ortogonalidad no puede justificarse. Estas desviaciones de la hibridación ideal fueron denominadas defectos de hibridación por Kutzelnigg . [20]
Espectros de fotoelectrones
Un concepto erróneo sobre la hibridación orbital es que predice incorrectamente los espectros de fotoelectrones ultravioleta de muchas moléculas. Si bien esto es cierto si el teorema de Koopmans se aplica a híbridos localizados, la mecánica cuántica requiere que la función de onda (en este caso ionizada) obedezca a la simetría de la molécula, lo que implica resonancia en la teoría del enlace de valencia. Por ejemplo, en el metano, los estados ionizados (CH 4 + ) se pueden construir a partir de cuatro estructuras de resonancia que atribuyen el electrón expulsado a cada uno de los cuatro orbitales sp 3 . Una combinación lineal de estas cuatro estructuras, conservando el número de estructuras, conduce a un estado T 2 triplemente degenerado y una A1 estado. [21] [22] La diferencia de energía entre cada estado ionizado y el estado fundamental sería la energía de ionización , que arroja dos valores de acuerdo con los resultados experimentales.
Orbitales moleculares localizados frente a canónicos
Los orbitales de enlace formados a partir de orbitales atómicos híbridos pueden considerarse orbitales moleculares localizados, que pueden formarse a partir de los orbitales deslocalizados de la teoría de orbitales moleculares mediante una transformación matemática apropiada. Para las moléculas en el estado fundamental, esta transformación de los orbitales deja sin cambios la función de onda total de muchos electrones. La descripción orbital híbrida del estado fundamental es, por lo tanto, equivalente a la descripción orbital deslocalizada de la energía total y la densidad electrónica del estado fundamental, así como la geometría molecular que corresponde al valor mínimo de energía total.
Dos representaciones localizadas
Las moléculas con múltiples enlaces o múltiples pares solitarios pueden tener orbitales representados en términos de simetría sigma y pi u orbitales equivalentes. Los diferentes métodos de enlace de valencia utilizan cualquiera de las dos representaciones, que tienen funciones de onda de muchos electrones totales matemáticamente equivalentes y están relacionadas por una transformación unitaria del conjunto de orbitales moleculares ocupados.
Para enlaces múltiples, la representación sigma-pi es la predominante en comparación con la representación orbital equivalente ( enlace doblado ). Por el contrario, para varios pares solitarios, la mayoría de los libros de texto utilizan la representación orbital equivalente. Sin embargo, la representación sigma-pi también se utiliza, como por Weinhold y Landis en el contexto de orbitales de enlace natural , una teoría orbital localizada que contiene análogos modernizados de pares de enlace clásicos (enlace de valencia / estructura de Lewis) y pares solitarios. [23] Para la molécula de fluoruro de hidrógeno, por ejemplo, dos pares solitarios F son esencialmente orbitales p sin hibridar, mientras que el otro es un sp xorbital híbrido. Una consideración análoga se aplica al agua (un par solitario O está en un orbital p puro, otro está en un orbital híbrido sp x ).
Ver también
- Teoría del campo cristalino
- Hibridación isovalente
- Teoría del campo de ligando
- Combinación lineal de orbitales atómicos
- Diagramas MO
- VALBOND
Referencias
- ^ Housecroft, Catherine E .; Sharpe, Alan G. (2005). Química inorgánica (2ª ed.). Pearson Prentice-Hal. pag. 100. ISBN 0130-39913-2.
- ^ Pauling, L. (1931), "La naturaleza del enlace químico. Aplicación de los resultados obtenidos de la mecánica cuántica y de una teoría de la susceptibilidad paramagnética a la estructura de las moléculas", Revista de la Sociedad Química Estadounidense , 53 (4) : 1367–1400, doi : 10.1021 / ja01355a027
- ^ Brittin, NOSOTROS (1945). "Ángulo de valencia del átomo de carbono tetraédrico". J. Chem. Educ. 22 (3): 145. Código Bibliográfico : 1945JChEd..22..145B . doi : 10.1021 / ed022p145 .
- ^ L. Pauling La naturaleza del enlace químico (3ª ed., Oxford University Press 1960) p.111-120.
- ^ Clayden, Jonathan ; Greeves, Nick; Warren, Stuart ; Wothers, Peter (2001). Química Orgánica (1ª ed.). Prensa de la Universidad de Oxford. pag. 105. ISBN 978-0-19-850346-0.
- ^ Química orgánica , tercera edición Marye Anne Fox James K. Whitesell 2003 ISBN 978-0-7637-3586-9
- ^ Química orgánica 3ª Ed. 2001 Paula Yurkanis Bruice ISBN 978-0-130-17858-9
- ^ "Ácidos y bases" . Orgo hecho simple . Consultado el 23 de junio de 2015 .
- ^ McMurray, J. (1995). Edición Anotada para Instructores de Química (4ª ed.). Prentice Hall. pag. 272. ISBN 978-0-131-40221-8
- ^ Gillespie, RJ (2004), "Enseñanza de la geometría molecular con el modelo VSEPR", Journal of Chemical Education , 81 (3): 298-304, Bibcode : 2004JChEd..81..298G , doi : 10.1021 / ed081p298
- ^ a b c Weinhold, Frank; Landis, Clark R. (2005). La valencia y la vinculación: una perspectiva de donante-aceptor de enlace orbital natural . Cambridge: Cambridge University Press. págs. 367, 374–376, 381–383. ISBN 978-0-521-83128-4.
- ^ a b Bayse, Craig; Hall, Michael (1999). "Predicción de las geometrías de complejos de polihidruro de metales de transición simple mediante análisis de simetría". Mermelada. Chem. Soc. 121 (6): 1348-1358. doi : 10.1021 / ja981965 + .
- ^ Kaupp, Martin (2001). " Estructuras y enlaces " no VSEPR "en sistemas d (0)". Angew Chem Int Ed Engl . 40 (1): 3534–3565. doi : 10.1002 / 1521-3773 (20011001) 40:19 <3534 :: AID-ANIE3534> 3.0.CO; 2- # . PMID 11592184 .
- ^ Magnusson, E. (1990). "Moléculas hipercoordinadas de elementos de segunda fila: funciones d orbitales d?". Mermelada. Chem. Soc . 112 (22): 7940–7951. doi : 10.1021 / ja00178a014 .
- ^ David L. Cooper; Terry P. Cunningham; Joseph Gerratt; Peter B. Karadakov; Mario Raimondi (1994). "Enlace químico a átomos hipercoordinados de segunda fila: participación orbital d versus democracia". Revista de la Sociedad Química Estadounidense . 116 (10): 4414–4426. doi : 10.1021 / ja00089a033 .
- ^ a b Richard D. Harcourt; Thomas M. Klapötke (2003). "Descripciones de valencia aumentada (enlace de valencia cualitativa) de las estructuras electrónicas de moléculas que contienen flúor ricas en electrones". Revista de química del flúor . 123 (1): 5-20. doi : 10.1016 / S0022-1139 (03) 00012-5 .
- ^ Frenking, Gernot; Shaik, Sason, eds. (2014). "Capítulo 3: La visión de NBO de enlaces químicos". El enlace químico: aspectos fundamentales del enlace químico . John Wiley e hijos. ISBN 978-3-527-66471-9.
- ^ Kaupp, Martin (2007). "El papel de los nodos radiales de los orbitales atómicos para los enlaces químicos y la tabla periódica" . Revista de Química Computacional . 28 (1): 320–325. doi : 10.1002 / jcc.20522 . ISSN 0192-8651 . PMID 17143872 . S2CID 12677737 .
- ^ Kaupp, Martin (2014) [1er. Pub. 2014]. "Capítulo 1: Enlace químico de los elementos del grupo principal". En Frenking, Gernod & Shaik, Sason (eds.). El enlace químico: enlace químico a través de la tabla periódica . Wiley-VCH. ISBN 978-1-234-56789-7.
- ^ Kutzelnigg, W. (agosto de 1988). "Híbridos ortogonales y no ortogonales". Revista de Estructura Molecular: THEOCHEM . 169 : 403–419. doi : 10.1016 / 0166-1280 (88) 80273-2 .
- ^ Andrei M. Tokmachev; Andrei L. Tchougreeff; Igor A. Misurkin (2001). "Potenciales de ionización dentro del producto antisimetrizado semiempírico del enfoque geminals estrictamente localizado". Revista Internacional de Química Cuántica . 85 (3): 109-117. doi : 10.1002 / qua.1060 .
- ^ Sason S. Shaik; Phillipe C. Hiberty (2008). Una guía química para la teoría del enlace de valencia . Nueva Jersey: Wiley-Interscience. págs. 104-106. ISBN 978-0-470-03735-5.
- ^ Weinhold, Frank; Landis, Clark R. (2012). Descubriendo la química con orbitales de enlace natural . Hoboken, Nueva Jersey: Wiley. págs. 67–68. ISBN 978-1-118-11996-9.
Enlaces externos
- Enlaces covalentes y estructura molecular
- Película flash de hibridación
- Programa de vista previa 3D orbital híbrido en OpenGL
- Comprensión de conceptos: orbitales moleculares
- Tutorial de química general sobre hibridación orbital

