Cruce entre sistemas
El cruce entre sistemas ( ISC ) es un proceso isoenergético sin radiación que implica una transición entre los dos estados electrónicos con diferentes estados de multiplicidad de espín . [1]
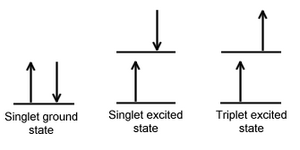
Cuando un electrón en una molécula con un estado fundamental singulete se excita ( a través de la absorción de radiación) a un nivel de energía más alto, se formará un estado singulete excitado o un estado triplete excitado. El estado singlete es un estado electrónico molecular en el que todos los espines de los electrones están emparejados. Es decir, el giro del electrón excitado todavía está emparejado con el electrón del estado fundamental (un par de electrones en el mismo nivel de energía deben tener giros opuestos, según el principio de exclusión de Pauli ). En estado de tripleteel electrón excitado ya no está emparejado con el electrón del estado fundamental; es decir, son paralelos (mismo giro). Dado que la excitación a un estado de triplete implica una transición de giro "prohibida" adicional, es menos probable que se forme un estado de triplete cuando la molécula absorbe radiación.
Cuando un estado singulete pasa de forma no radiativa a un estado triplete o, por el contrario, un triplete pasa a ser un singulete, ese proceso se conoce como cruce entre sistemas. En esencia, el giro del electrón excitado se invierte. La probabilidad de que ocurra este proceso es más favorable cuando los niveles vibratorios de los dos estados excitados se superponen, ya que se debe ganar o perder poca o ninguna energía en la transición. Como las interacciones espín/orbital en tales moléculas son sustanciales y un cambio en el espín es más favorable, el cruce entre sistemas es más común en moléculas de átomos pesados (p. ej., aquellas que contienen yodo o bromo ). Este proceso se llama " acoplamiento espín-órbita ".". En pocas palabras, implica el acoplamiento del espín del electrón con el momento angular orbital de las órbitas no circulares. Además, la presencia de especies paramagnéticas en solución mejora el cruce entre sistemas. [2]
El decaimiento radiativo desde un estado de triplete excitado de vuelta a un estado de singlete se conoce como fosforescencia . Dado que se produce una transición en la multiplicidad de espín, la fosforescencia es una manifestación del cruce entre sistemas. La escala de tiempo del cruce entre sistemas es del orden de 10 −8 a 10 −3 s, una de las formas más lentas de relajación. [3]
Una vez que un complejo metálico se somete a la transferencia de carga de metal a ligando , el sistema puede experimentar un cruce entre sistemas, lo que, junto con la capacidad de ajuste de las energías de excitación de MLCT, produce un intermedio de larga duración cuya energía se puede ajustar alterando los ligandos utilizados en el complejo. Luego, otra especie puede reaccionar con el estado excitado de larga duración a través de la oxidación o la reducción, iniciando así una vía redox a través de la fotoexcitación sintonizable . Los complejos que contienen centros metálicos de alto número atómico d 6 , como Ru(II) e Ir(III), se usan comúnmente para tales aplicaciones debido a que favorecen el cruce entre sistemas como resultado de su acoplamiento espín-órbita más intenso. [4]