Síntesis de quinolina de Knorr
| Síntesis de quinolina de Knorr | |
|---|---|
| Lleva el nombre de | Ludwig Knorr |
| Tipo de reacción | Reacción de formación de anillo |
| Identificadores | |
| ID de ontología RSC | RXNO: 0000394 |
La síntesis de quinolina de Knorr es una reacción orgánica intramolecular que convierte una β-cetoanilida en una 2-hidroxiquinolina utilizando ácido sulfúrico . Esta reacción fue descrita por primera vez por Ludwig Knorr (1859-1921) en 1886 [1].
La reacción es un tipo de sustitución aromática electrofílica acompañada de eliminación de agua. Un estudio de 1964 encontró que con ciertas condiciones de reacción la formación de una 4-hidroxiquinolina es una reacción competitiva. [2] Por ejemplo, el compuesto benzoilacetanilida ( 1 ) forma la 2-hidroxiquinolina ( 2 ) en un gran exceso de ácido polifosfórico (PPA) pero 4-hidroxiquinolina 3 cuando la cantidad de PPA es pequeña. Un mecanismo de reacción identificó un intermedio A N, O-dicatiónico con exceso de ácido capaz de cerrar el anillo y un intermedio B monocatiónico que se fragmenta en anilinay (finalmente a) acetofenona . La anilina reacciona con otro equivalente de benzoilacetanilida antes de formar la 4-hidroxiquinolina.
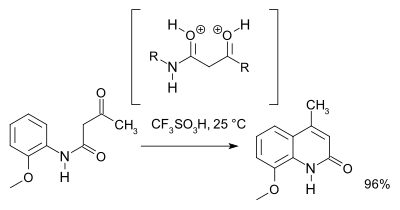
Un estudio de 2007 [3] revisó el mecanismo de reacción y, basado en espectroscopía de RMN y cálculos teóricos, favorece un intermedio O, O-dicatiónico (un superelectrófilo ) sobre el intermedio N, O dicacional. Para fines preparativos se recomienda el ácido tríflico :
Referencias
- ^ Synthetische Versuche mit dem Acetessigester Justus Liebig's Annalen der Chemie Volume 236, Issue 1-2, Fecha: 1886 , Páginas: 69-115 Ludwig Knorr doi : 10.1002 / jlac.18862360105
- ^ La conversión de benzoilacetanilidas en 2- y 4-hidroxiquinolinas B. Staskun J. Org. Chem. 1964 ; 29 (5); 1153-1157. doi : 10.1021 / jo01028a038
- ^ Ciclizaciones de Knorr y superelectrófilos distónicos Kiran Kumar Solingapuram Sai, Thomas M. Gilbert y Douglas A. Klumpp J. Org. Chem. 2007 , 72, 9761–9764 doi : 10.1021 / jo7013092