 | |
| Nombres | |
|---|---|
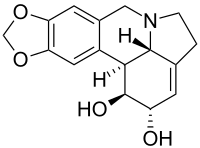
| Nombre IUPAC 1,2,4,5,12b, 12c-Hexahidro-7 H - [1,3] dioxolo [4,5-j] pirrolo [3,2,1- de ] fenantridina-1,2-diol | |
| Otros nombres Galantidina, Amarilina, Narcisina, Licorina, Belamarina | |
| Identificadores | |
Modelo 3D ( JSmol ) | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA | 100.006.822 |
PubChem CID | |
| UNII | |
Tablero CompTox ( EPA ) | |
| |
| |
| Propiedades | |
| C 16 H 17 N O 4 | |
| Masa molar | 287,315 g · mol −1 |
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |
| Referencias de Infobox | |
La licorina es un alcaloide cristalino tóxico que se encuentra en varias especies de Amaryllidaceae , como el lirio arbustivo cultivado ( Clivia miniata ), los lirios sorpresa ( Lycoris ) y los narcisos ( Narcissus ). Puede ser muy venenoso, o incluso letal, cuando se ingiere en determinadas cantidades. [1] Independientemente, a veces se usa con fines medicinales, una razón por la cual algunos grupos pueden cosechar la muy popular Clivia miniata .
Fuente [ editar ]
Lycorine se encuentra en diferentes especies de Amaryllidaceae que incluyen flores y bulbos de narciso, campanilla blanca ( Galanthus ) o lirio araña ( Lycoris ). La licorina es el alcaloide más frecuente de Amaryllidaceae . [2]
La diversificación más temprana de Amaryllidaceae fue más probable en el norte de África y la península Ibérica y que la licorina es una de las más antiguas en la vía biosintética de alcaloides de Amaryllidaceae. [3]
Mecanismo de acción [ editar ]
Actualmente se sabe muy poco sobre el mecanismo de la licorina. Hay ideas provisionales sobre cómo se metaboliza la licorina debido a un estudio realizado en perros beagle . [4]
La licorina inhibe la síntesis de proteínas , [5] y puede inhibir la biosíntesis del ácido ascórbico , aunque los estudios sobre este último son controvertidos y no concluyentes. Actualmente, tiene cierto interés en el estudio de ciertas levaduras , el principal organismo en el que se prueba la licorina. [6]
Se sabe que la licorina inhibe débilmente la biosíntesis de acetilcolinesterasa (AChE) y ácido ascórbico. [7] Se encontró que el IC50 de la licorina varía entre las diferentes especies en las que se puede encontrar, pero una deducción común de los experimentos con la licorina fue que tenía algún efecto sobre la inhibición de la AChE. [8]
La lycorine exhibe efectos citostáticos al dirigirse al citoesqueleto de actina en lugar de inducir la apoptosis en las células cancerosas, aunque se encontró que la lycorine produce apoptosis en diferentes etapas del ciclo celular. [9]
Biosíntesis [ editar ]
Una posible síntesis de licorina podría provenir de la O-Metilnorbelladina , que se puede ver en la imagen de la derecha.
Toxicidad [ editar ]
El envenenamiento por licorina ocurre típicamente con la ingestión de bulbos de narciso. Los bulbos de narciso a veces se confunden con cebollas , lo que provoca una intoxicación accidental. [10]
En un estudio de la dosis utilizada en perros beagle, el primer signo de náuseas se observó con una dosis tan pequeña de 0,5 mg / kg y se produjo en un lapso de 2,5 horas. Se observó que la dosis eficaz para inducir la emesis en los perros era de 2,0 mg / kg y no duró más de 2,5 horas después de la administración. [11]
Síntomas [ editar ]
Los síntomas de la toxicidad por licorina son náuseas , [12] vómitos , diarrea y convulsiones . [13]
Investigación actual [ editar ]
Se ha visto que la licorina tiene actividades biológicas y farmacológicas prometedoras, como efectos antibacterianos, antivirales o antiinflamatorios, y puede tener propiedades anticancerígenas. [14] Ha mostrado varias propiedades inhibidoras de múltiples líneas celulares de cáncer que incluyen linfoma, carcinoma, mieloma múltiple, melanoma, leucemia, cáncer de pulmón de células no pequeñas A549 humano, cáncer de esófago OE21 humano y más. [15]
La licorina tiene muchos derivados utilizados para la investigación contra el cáncer, como el clorhidrato de licorina (LH), que es un nuevo agente contra el cáncer de ovario, y los datos han demostrado que la LH inhibe eficazmente la proliferación mitótica de las células Hey1B con muy baja toxicidad. Este fármaco podría utilizarse para una terapia eficaz contra el cáncer de ovario en el futuro. [dieciséis]
Referencias [ editar ]
- ^ "T3DB: Lycorine" . www.t3db.ca . Consultado el 12 de noviembre de 2018 .
- ^ Jahn, Sandra; Seiwert, Bettina; Kretzing, Sascha; Abraham, Getu; Regenthal, Ralf; Karst, Uwe (2012). "Estudios metabólicos de los alcaloides amarilidáceos galantamina y licorina basados en simulación electroquímica además de modelos in vivo e in vitro" . Analytica Chimica Acta . 756 (756): 60–72. doi : 10.1016 / j.aca.2012.10.042 . PMID 23176740 . Consultado el 25 de abril de 2017 .
- ^ Berkov, Strahil; Martínez-Frances, Vanessa; Bastida, Jaume; Codina, Carles; Ríos, Sequndo (2014). "Evolución de la biosíntesis de alcaloides en el género Narcissus" . Fitoquímica . 99 (99): 95–106. doi : 10.1016 / j.phytochem.2013.11.002 . PMID 24461780 .
- ^ Kretzing, Sascha; Abraham, Getu; Seiwert, Bettina; Ungemach, Fritz Rupert; Krugel, Ute; Regenthal, Ralf (2011). "Efectos eméticos dependientes de la dosis de la licorina alcaloide amarilidáceo en perros beagle" . Toxicon . 57 (57): 117-124. doi : 10.1016 / j.toxicon.2010.10.012 . PMID 21055413 . Consultado el 25 de abril de 2017 .
- ^ Vrijsen R, Vanden Berghe DA, Vlietinck AJ, Boeyé A (1986). "Lycorine: ¿un inhibidor de terminación eucariota?". J. Biol. Chem . 261 (2): 505–7. PMID 3001065 .
- ^ Garuccio I, Arrigoni O (1989). "[Varias sensibilidades de las levaduras a la licorina]". Cápsula. Soc. Ital. Biol. Sper. (en italiano). 65 (6): 501–8. PMID 2611011 .
- ^ Jahn, Sandra; Seiwert, Bettina; Kretzing, Sascha; Abraham, Getu; Regenthal, Ralf; Karst, Uwe (2012). "Estudios metabólicos de los alcaloides amarilidáceos galantamina y licorina basados en simulación electroquímica además de modelos in vivo e in vitro" . Analytica Chimica Acta . 756 (756): 60–72. doi : 10.1016 / j.aca.2012.10.042 . PMID 23176740 . Consultado el 25 de abril de 2017 .
- ^ Eliseo, IL; Elgorashi, EE; Hussein, AA; Duncan, G .; Eloff, JN (2013). "Efectos inhibidores de la acetilcolinesterasa del bulbo de Ammocharis coranica (Amaryllidaceae) y su componente activo licorina" . Revista Sudafricana de Botánica (85): 44–47 . Consultado el 25 de abril de 2017 .
- ^ Wang, Peng; Yuan, Hui-Hui; Zhang, Xue; Li, Yun-Ping; Shang, Lu-Qing; Yin, Zheng (21 de febrero de 2014). "Nuevos derivados de licorina como agentes anticancerígenos: síntesis y evaluación biológica in vitro" . Moléculas . 19 (2): 2469–2480. doi : 10,3390 / moléculas19022469 . PMC 6271160 . PMID 24566315 . Consultado el 25 de abril de 2017 .
- ^ Alumnos enfermos después de que se pusiera el bulbo en la sopa , BBC News , 3 de mayo de 2009
- ^ Kretzing, Sascha; Abraham, Getu; Seiwert, Bettina; Ungemach, Fritz Rupert; Krugel, Ute; Regenthal, Ralf (2011). "Efectos eméticos dependientes de la dosis de la licorina alcaloide amarilidáceo en perros beagle" . Toxicon . 57 (57): 117-124. doi : 10.1016 / j.toxicon.2010.10.012 . PMID 21055413 . Consultado el 25 de abril de 2017 .
- ^ Kretzing, Sascha; Abraham, Getu; Seiwert, Bettina; Ungemach, Fritz Rupert; Krugel, Ute; Regenthal, Ralf (2011). "Efectos eméticos dependientes de la dosis de la licorina alcaloide amarilidáceo en perros beagle" . Toxicon . 57 (57): 117-124. doi : 10.1016 / j.toxicon.2010.10.012 . PMID 21055413 . Consultado el 25 de abril de 2017 .
- ^ Lycorine , definición en mercksource.com
- ^ Jahn, Sandra; Seiwert, Bettina; Kretzing, Sascha; Abraham, Getu; Regenthal, Ralf; Karst, Uwe (2012). "Estudios metabólicos de los alcaloides amarilidáceos galantamina y licorina basados en simulación electroquímica además de modelos in vivo e in vitro" . Analytica Chimica Acta . 756 (756): 60–72. doi : 10.1016 / j.aca.2012.10.042 . PMID 23176740 . Consultado el 25 de abril de 2017 .
- ^ Wang, Peng; Yuan, Hui-Hui; Zhang, Xue; Li, Yun-Ping; Shang, Lu-Qing; Yin, Zheng (21 de febrero de 2014). "Nuevos derivados de licorina como agentes anticancerígenos: síntesis y evaluación biológica in vitro" . Moléculas . 19 (2): 2469–2480. doi : 10,3390 / moléculas19022469 . PMC 6271160 . PMID 24566315 . Consultado el 25 de abril de 2017 .
- ^ Cao, Zhifei; Yu, Di; Fu, Shilong; Zhang, Gaochuan; Pan, Yanyan; Bao, Meimei; Tu, Jian; Shang, Bingxue; Guo, Pengda; Yang, Ping; Zhou, Quansheng (2013). "El clorhidrato de licorina inhibe selectivamente la proliferación de células de cáncer de ovario humano y la neovascularización tumoral con muy baja toxicidad" . Cartas de toxicología . 218 (2): 174-185. doi : 10.1016 / j.toxlet.2013.01.018 . PMID 23376478 . Consultado el 25 de abril de 2017 .
Enlaces externos [ editar ]
- Hill, RK; Joule, JA; Loeffler, LJ (1962). "Síntesis estereoselectiva de d, l-α- y β-Lycoranes". Revista de la Sociedad Química Estadounidense . 84 (24): 4951–4956. doi : 10.1021 / ja00883a064 .
- Wolfgang Oppolzer; Alan C. Spivey y Christian G. Bochet (1994). "Suprafacialidad de ciclizaciones térmicas de N-4-alquenilhidroxilamina: síntesis de (±) -α-Lycorane y (+) - tiantina" (PDF) . Mermelada. Chem. Soc . 116 (7): 3139–3140. doi : 10.1021 / ja00086a060 . Archivado desde el original (PDF) el 14 de junio de 2011 . Consultado el 4 de noviembre de 2009 .