| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1-bromopirrolidina-2,5-diona | |||
| Otros nombres N- bromosuccinimida; Oficina nacional de normas | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| 113916 | |||
| CHEBI | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.004.435 | ||
| Número CE |
| ||
| 26634 | |||
PubChem CID | |||
| UNII | |||
Tablero CompTox ( EPA ) | |||
| |||
| |||
| Propiedades | |||
| C 4 H 4 Br N O 2 | |||
| Masa molar | 177,985 g · mol −1 | ||
| Apariencia | Blanco sólido | ||
| Densidad | 2.098 g / cm 3 (sólido) | ||
| Punto de fusion | 175 a 178 ° C (347 a 352 ° F; 448 a 451 K) | ||
| Punto de ebullición | 339 ° C (642 ° F; 612 K) | ||
| 14,7 g / L (25 ° C) | |||
| Solubilidad en CCl 4 | Insoluble (25 ° C) | ||
| Riesgos | |||
| Principales peligros | Irritante | ||
| Ficha de datos de seguridad | [1] | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
La N- bromosuccinimida o NBS es un reactivo químico que se utiliza en reacciones de sustitución de radicales , adición electrofílica y sustitución electrofílica en química orgánica . NBS puede ser una fuente conveniente de Br • , elradical bromo .
Preparación
NBS está disponible comercialmente. También se puede sintetizar en el laboratorio. Para ello, se añaden hidróxido de sodio y bromo a una solución de succinimida en agua helada . El producto NBS precipita y puede recogerse mediante filtración. [1]
El NBS crudo proporciona un mejor rendimiento en la reacción de Wohl-Ziegler . En otros casos, NBS impuro (de color ligeramente amarillo) puede dar resultados poco fiables. Puede purificarse mediante recristalización en agua a 90–95 ° C (10 g de NBS por 100 ml de agua). [2]
Reacciones
Adición a los alquenos
NBS reaccionará con alquenos 1 en disolventes acuosos para dar bromohidrinas 2 . Las condiciones preferidas son la adición en porciones de NBS a una solución del alqueno en DMSO , DME , THF o terc- butanol acuoso al 50% a 0ºC. [3] La formación de un ion bromonio y el ataque inmediato del agua da lugar a una fuerte adición de Markovnikov y selectividades anti- estereoquímicas. [4]
Las reacciones secundarias incluyen la formación de α-bromocetonas y compuestos dibromo. Estos pueden minimizarse mediante el uso de NBS recién recristalizado .
Con la adición de nucleófilos , en lugar de agua , se pueden sintetizar varios alcanos bifuncionales. [5]
Bromación alílica y bencílica
Las condiciones estándar para usar NBS en bromación alílica y / o bencílica implican reflujo de una solución de NBS en CCl 4 anhidro con un iniciador de radicales, generalmente azobisisobutironitrilo ( AIBN ) o peróxido de benzoílo , irradiación o ambos para efectuar la iniciación de radicales . [6] [7] Los radicales intermedios alílico y bencílico formados durante esta reacción son más estables que otros radicales de carbono y los productos principales son bromuros alílicos y bencílicos. Esto también se denomina reacción de Wohl-Ziegler . [8] [9]
El tetracloruro de carbono debe mantenerse anhidro durante toda la reacción, ya que es probable que la presencia de agua hidrolice el producto deseado. [10] A menudo se agrega carbonato de bario para mantener condiciones anhidras y libres de ácido.
En la reacción anterior, aunque es posible una mezcla de productos de bromuro alílico isomérico, solo se crea uno debido a la mayor estabilidad del radical de la posición 4 sobre el radical centrado en metilo.
Bromación de derivados carbonílicos
NBS puede α-bromar derivados de carbonilo mediante una ruta de radicales (como antes) o mediante catálisis ácida. Por ejemplo, el cloruro de hexanoílo 1 se puede bromar en la posición alfa mediante NBS usando catálisis ácida. [11]
La reacción de enolatos , enol éteres o enol acetatos con NBS es el método preferido de α-bromación, ya que tiene un alto rendimiento y pocos productos secundarios. [12] [13]
Bromación de derivados aromáticos
Los compuestos aromáticos ricos en electrones, como los fenoles , las anilinas y varios heterociclos aromáticos , [14] pueden bromarse usando NBS. [15] [16] El uso de DMF como disolvente proporciona altos niveles de paraselectividad. [17]
Reordenamiento de Hofmann
NBS, en presencia de una base fuerte, como DBU , reacciona con amidas primarias para producir un carbamato a través de la transposición de Hofmann . [18]
Oxidación selectiva de alcoholes
Es poco común, pero posible que NBS oxide los alcoholes. EJ Corey y col. encontró que se pueden oxidar selectivamente alcoholes secundarios en presencia de alcoholes primarios usando NBS en dimetoxietano acuoso (DME). [19]
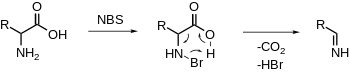
Descarboxilación oxidativa de α-aminoácidos
NBS broma electrofílicamente la amina, a lo que sigue la descarboxilación y liberación de una imina. La hidrólisis adicional producirá un aldehído y amoníaco. [20] [21] (cf. descarboxilación dependiente de PLP no oxidativa)
Precauciones
Aunque el NBS es más fácil y seguro de manipular que el bromo, se deben tomar precauciones para evitar la inhalación. NBS debe almacenarse en un refrigerador. NBS se descompondrá con el tiempo emitiendo bromo. El NBS puro es blanco, pero a menudo se encuentra blanquecino o marrón por el bromo.
En general, las reacciones que involucran NBS son exotérmicas. Por lo tanto, se deben tomar precauciones adicionales cuando se usa a gran escala.
Ver también
- Formación de halohidrina
- N- clorosuccinimida
- N- Iodosuccinimida
Referencias
- ^ Ziegler, K .; Späth, A. (1942). "Die Halogenierung ungesättigter Substanzen in der Allylstellungs". Ana. Chem. 551 (1): 80-119. doi : 10.1002 / jlac.19425510103 .
- ^ Dauben, HJ, Jr; McCoy, LL (1959). " N- bromosuccinimida. I. Bromación alílica, un estudio general de las variables de reacción". Mermelada. Chem. Soc. 81 (18): 4863–4873. doi : 10.1021 / ja01527a027 .
- ^ Hanzlik, RP "Epoxidación selectiva de dobles enlaces terminales" . Síntesis orgánicas .; Volumen colectivo , 6 , p. 560
- ^ Beger, J. (1991). "Präparative Aspekte elektrophiler Dreikomponentenreaktionen mit Alkenen" [Aspectos preparativos de reacciones electrofílicas de tres componentes con alquenos]. J. Prakt. Chem. 333 (5): 677–698. doi : 10.1002 / prac.19913330502 .
- ^ Haufe, G .; Alvernhe, G .; Laurent, A .; Ernet, T .; Goj, O .; Kröger, S .; Sattler, A. (2004). "Bromofluoración de alquenos" . Síntesis orgánicas .; Volumen colectivo , 10 , p. 128
- ^ Djerassi, Carl (1948). "Bromaciones con N- bromosuccinimida y compuestos relacionados. La reacción de Wohl-Ziegler". Chem. Rev. 43 (2): 271–317. doi : 10.1021 / cr60135a004 . PMID 18887958 .
- ^ Greenwood, FL; Kellert, MD; Sedlak, J. (1963). "4-Bromo-2-hepteno" . Síntesis orgánicas .; Volumen colectivo , 4 , p. 108
- ^ Wohl, A. (1919). "Bromierung ungesättigter Verbindungen mit N -Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge" [Bromación de compuestos insaturados con N -bromoacetamida, una contribución a la teoría del curso de los procesos químicos]. Berichte der Deutschen Chemischen Gesellschaft (Series A y B) . 52 : 51–63. doi : 10.1002 / cber.19190520109 .
- ^ Ziegler, K .; Schenck, G .; Krockow, EW; Siebert, A .; Wenz, A .; Weber, H. (1942). "Die Synthese des Cantharidins" [La síntesis de cantaridina]. Annalen der Chemie de Justus Liebig . 551 : 1-79. doi : 10.1002 / jlac.19425510102 .
- ^ Binkley, RW; Goewey, GS; Johnston, J. (1984). "Apertura regioselectiva del anillo de acetales de bencilideno seleccionados. Una reacción iniciada fotoquímicamente para la desprotección parcial de carbohidratos". J. Org. Chem. 49 (6): 992. doi : 10.1021 / jo00180a008 .
- ^ Harpp, DN; Bao, LQ; Coyle, C .; Gleason, JG; Horovitch, S. (1988). "Cloruro de 2-bromohexanoílo" . Síntesis orgánicas .; Volumen colectivo , 6 , p. 190
- ^ Stotter, PL; Hill, KA (1973). "Compuestos α-halocarbonilo. II. Preparación específica de posición de α-bromocetonas mediante bromación de enolatos de litio. Introducción específica de posición de α, β-insaturación en cetonas asimétricas". J. Org. Chem. 38 (14): 2576. doi : 10.1021 / jo00954a045 .
- ^ Lichtenthaler, FW (1992). "Varios donantes de glucosilo con función cetona u oxima junto al centro anomérico: fácil preparación y evaluación de sus selectividades en glucosidaciones". Síntesis . 1992 : 179–84. doi : 10.1055 / s-1992-34167 .
- ↑ Amat, M .; Hadida, S .; Sathyanarayana, S .; Bosc, J. (1998). "Síntesis regioselectiva de indoles 3-sustituidos" . Síntesis orgánicas .; Volumen colectivo , 9 , p. 417
- ^ Gilow, HW; Burton, DE (1981). "Bromación y cloración de pirrol y algunos pirrol reactivos 1-sustituidos". J. Org. Chem. 46 (11): 2221. doi : 10.1021 / jo00324a005 .
- ^ Marrón, WD; Gouliaev, AH (2005). "Síntesis de 5-bromoisoquinolina y 5-bromo-8-nitroisoquinolina" . Síntesis orgánicas . 81 : 98.
- ^ Mitchell, RH; Lai, YH; Williams, RV (1979). " N -bromosuccinimida-dimetilformamida: un reactivo de monobromación nuclear selectiva suave para compuestos aromáticos reactivos". J. Org. Chem. 44 (25): 4733. doi : 10.1021 / jo00393a066 .
- ^ Keillor, JW; Huang, X. (2004). "Formación de carbamato de metilo a través de reacciones de transposición de Hofmann modificadas" . Síntesis orgánicas .; Volumen colectivo , 10 , p. 549
- ^ Corey, EJ ; Ishiguro, M (1979). "Síntesis total de (±) -2-isocianopupuceanane". Tetrahedron Lett. 20 (30): 2745–2748. doi : 10.1016 / S0040-4039 (01) 86404-2 .
- ^ Ramachandran, MS; Easwaramoorthy, D .; Rajasingh, V .; Vivekanandam, TS (1 de enero de 1990). " Descarboxilación oxidativa promovida por N -clorosuccinimida de α-aminoácidos en medio alcalino acuoso" . Boletín de la Sociedad Química de Japón . 63 (8): 2397–2403. doi : 10.1246 / bcsj.63.2397 .
- ^ Song, Xuezheng; Ju, Hong; Zhao, Chunmei; Lasanajak, Yi (15 de octubre de 2014). "Estrategia novedosa para liberar y etiquetar N- glicanos para glicomicos funcionales" . Química del bioconjugado . 25 (10): 1881–1887. doi : 10.1021 / bc500366v . ISSN 1043-1802 . PMC 4197647 . PMID 25222505 .
Enlaces externos
- Uso de N -bromosuccinimida en síntesis orgánica
- Reacciones con NBS