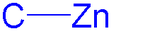Compuesto de organozinc
Los compuestos orgánicos de zinc en química orgánica contienen enlaces químicos de carbono a zinc . La química de organozinc es la ciencia de los compuestos de organozinc que describe sus propiedades físicas, síntesis y reacciones. [1] [2] [3] [4]
Los compuestos organozinc estuvieron entre los primeros compuestos organometálicos fabricados. Son menos reactivos que muchos otros reactivos organometálicos análogos, como los reactivos de Grignard y organolitio . En 1848 , Edward Frankland preparó el primer compuesto orgánico de zinc, el dietilzinc , calentando yoduro de etilo en presencia de zinc metálico. [5] Esta reacción produjo un líquido incoloro volátil que se quemó espontáneamente al entrar en contacto con el aire. Debido a su naturaleza pirofórica , los compuestos orgánicos de zinc generalmente se preparan utilizando técnicas sin aire . Son inestables frente a los disolventes próticos .. Para muchos propósitos se preparan in situ , no se aíslan, pero muchos se han aislado como sustancias puras y se han caracterizado minuciosamente. [6]
Los organocincos se pueden clasificar según el número de sustituyentes de carbono que están unidos al metal. [2] [3]
En sus complejos de coordinación, el zinc (II) adopta varias geometrías de coordinación, comúnmente octaédrica , tetraédrica y varias geometrías pentacoordinadas. Esta flexibilidad estructural se puede atribuir a la configuración electrónica del zinc [Ar]3d 10 4s 2 . El orbital 3d está lleno y, por lo tanto, los efectos de campo del ligando son inexistentes. La geometría de coordinación está determinada en gran medida por interacciones electrostáticas y estéricas. [2] Los compuestos orgánicos de zinc suelen tener dos o tres coordenadas, lo que refleja la propiedad fuertemente donante de los ligandos carbaniónicos.
Los complejos típicos de diorganozinc tienen la fórmula R 2 Zn. Los compuestos de dialquilzinc son monoméricos con una coordinación lineal en el átomo de zinc. [7] Existe un enlace covalente polar entre el carbono y el zinc, polarizado hacia el carbono debido a las diferencias en los valores de electronegatividad (carbono: 2,5 y zinc: 1,65). El momento dipolar de los reactivos diorganozinc simétricos puede verse como cero en estos complejos lineales, lo que explica su solubilidad en solventes no polares como el ciclohexano . A diferencia de otros alquilos de metales binarios, las especies de diorganozinc muestran una baja afinidad por la formación de complejos con disolventes etéreos . La unión en R 2 Zn se describe como el empleo de sp-orbitales hibridados en Zn. [2]
Estas estructuras hacen que el zinc tenga dos orbitales d enlazantes y tres orbitales d no enlazantes bajos (ver orbital no enlazante ), que están disponibles para unirse. Cuando el zinc carece de ligandos donantes de electrones, no puede obtener la saturación de coordinación, que es una consecuencia del gran radio atómico y la baja deficiencia de electrones del zinc. Por lo tanto, es raro que se produzcan puentes entre grupos alquilo o arilo debido a la débil deficiencia de electrones del átomo de zinc. Aunque ocurre en algunos casos, como Ph 2 Zn (que se muestra a continuación) y qué halógenos son los organozinc, pueden formar grupos de metales (ver química de grupos ). Cuando se añade un ligando de halógeno al átomo de zinc, tanto el carácter aceptor como el donante del zinc mejoran, lo que permite la agregación.[2]