Rinovirus
| Rinovirus | |
|---|---|
 | |
| Rinovirus | |
| clasificación cientifica | |
| (no clasificado): | Virus |
| Reino : | Riboviria |
| Reino: | Orthornavirae |
| Filo: | Pisuviricota |
| Clase: | Pisoniviricetes |
| Pedido: | Picornavirales |
| Familia: | Picornaviridae |
| Género: | Enterovirus |
| Grupos incluidos | |
| |
| Taxones incluidos cladísticamente pero excluidos tradicionalmente | |
| |
El rinovirus (del griego antiguo : ῥίς , romanizado : rhis "nariz", gen ῥινός , romanizado: rinocerontes "de la nariz", y el latín : vīrus ) es el agente infeccioso viral más común en humanos y es la causa predominante de el resfriado común . La infección por rinovirus prolifera a temperaturas de 33 a 35 ° C (91 a 95 ° F), las temperaturas que se encuentran en la nariz. Los rinovirus pertenecen al género Enterovirus de la familia Picornaviridae .
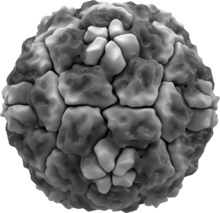
Las tres especies de rinovirus (A, B y C) incluyen alrededor de 160 tipos reconocidos de rinovirus humanos que difieren según sus proteínas de superficie ( serotipos ). [1] Son de naturaleza lítica y se encuentran entre los virus más pequeños, con diámetros de unos 30 nanómetros. En comparación, otros virus, como la viruela y la vacuna , son alrededor de diez veces más grandes a unos 300 nanómetros , mientras que los virus de la gripe tienen alrededor de 80 a 120 nm.
Historia
En 1953, cuando un grupo de enfermeras desarrolló una enfermedad respiratoria leve, Winston Price , de la Universidad Johns Hopkins , tomó muestras de los conductos nasales y aisló el primer rinovirus, al que llamó virus JH, que lleva el nombre de Johns Hopkins. [2] [3] Sus hallazgos se publicaron en 1956. [4]
Transmisión y epidemiología
Hay dos modos de transmisión: a través de aerosoles de gotitas respiratorias y de fómites (superficies contaminadas), incluido el contacto directo de persona a persona.
Los rinovirus se propagan por todo el mundo y son la causa principal del resfriado común . Los síntomas incluyen dolor de garganta , secreción nasal , congestión nasal , estornudos y tos ; a veces acompañado de dolores musculares , fatiga , malestar , dolor de cabeza , debilidad muscular o pérdida del apetito . La mayoría de los hallazgos de los senos nasales son reversibles, lo que coincide con un proceso viral autolimitado típico de los resfriados por rinovirus. La fiebre y el agotamiento extremo son más habituales en la influenza.. Los niños pueden tener de seis a doce resfriados al año. En los Estados Unidos, la incidencia de resfriados es mayor en otoño e invierno, y la mayoría de las infecciones ocurren entre septiembre y abril. La estacionalidad puede deberse al comienzo del año escolar [ cita requerida ] ya que las personas pasan más tiempo en el interior, lo que aumenta la posibilidad de transmisión del virus. [5] Las temperaturas ambiente más bajas, especialmente al aire libre, también pueden ser un factor [6]dado que los rinovirus se replican preferentemente a 32 ° C (89 ° F) en lugar de 37 ° C (98 ° F). Los pólenes, pastos, henos y prácticas agrícolas variantes pueden ser factores en la estacionalidad, así como en el uso de controles químicos de césped, potreros y campos deportivos en escuelas y comunidades. Los cambios en los patrones de temperatura, humedad y viento parecen ser factores. También se postula que la vivienda deficiente, el hacinamiento y las condiciones insalubres relacionadas con la pobreza son factores relevantes en la transmisión del 'resfriado común'.
Los más afectados por los rinovirus son los bebés, los ancianos y las personas inmunodeprimidas . [7]
Patogénesis
La principal vía de entrada de los rinovirus humanos es el tracto respiratorio superior (boca y nariz). Los rinovirus A y B usan ICAM-1 (molécula de adhesión intercelular 1) "principal" , también conocida como CD54 (grupo de diferenciación 54), en las células epiteliales respiratorias, como receptores a los que unirse. En su lugar, algunos subgrupos de A y B utilizan el receptor de LDL "menor" . [8] El rinovirus C utiliza el miembro 3 de la familia relacionado con la cadherina (CDHR3) para mediar la entrada celular. [9] A medida que el virus se replica y se propaga, las células infectadas liberan señales de angustia conocidas como quimiocinas y citocinas.(que a su vez activan mediadores inflamatorios). La lisis celular ocurre en el epitelio respiratorio superior .
La infección ocurre rápidamente y el virus se adhiere a los receptores de superficie dentro de los 15 minutos posteriores a su entrada en el tracto respiratorio. Poco más del 50% de las personas experimentarán síntomas dentro de los 2 días posteriores a la infección. Solo alrededor del 5% de los casos tendrá un período de incubación de menos de 20 horas y, en el otro extremo, se espera que el 5% de los casos tenga un período de incubación de más de cuatro días y medio. [10]
Los rinovirus humanos crecen preferentemente a 32 ° C (89 ° F), notablemente más frío que la temperatura media del cuerpo humano de 37 ° C (98 ° F); de ahí la tendencia del virus a infectar el tracto respiratorio superior , donde el flujo de aire respiratorio está en contacto continuo con el ambiente (más frío) extrasomático.
El rinovirus C, a diferencia de las especies A y B, puede causar infecciones graves. [11] Esta asociación desaparece después de controlar los factores de confusión . [12] Debidamente, entre los bebés infectados con enfermedades respiratorias sintomáticas en áreas de bajos recursos, no parece haber asociación entre las especies de rinovirus y la gravedad de la enfermedad. [13]
Taxonomía
El rinovirus era anteriormente un género de la familia Picornaviridae . El 39º Comité Ejecutivo (EC39) del Comité Internacional de Taxonomía de Virus (ICTV) se reunió en Canadá durante junio de 2007 con nuevas propuestas taxonómicas. En abril de 2008, el Comité Internacional de Taxonomía de Virus votó y ratificó los siguientes cambios:
- 2005.264V.04 Para eliminar las siguientes especies del género Rhinovirus existente en la familia Picornaviridae :
- Rinovirus humano A
- Rinovirus humano B
- 2005.265V.04 Asignar las siguientes especies al género Enterovirus de la familia Picornaviridae :
- Rinovirus humano A
- Rinovirus humano B
- 2005.266V.04 Para eliminar el género Rhinovirus existente de la familia Picornaviridae . Nota: El género Rhinovirus desaparece por la presente.
La fusión se basa en que los dos "géneros" de virus no son significativamente diferentes en un sentido virológico. Tienen organizaciones genómicas y estructuras de partículas idénticas, y la filogenia no siempre es monofilética.
En julio de 2009, el ICTV votó y ratificó una propuesta para agregar una tercera especie, el rinovirus humano C, al género Enterovirus .
- 2008.084VAHRV-C-Sp 2008.084V Crear una nueva especie denominada Rinovirus humano C en el género Enterovirus , familia Picornaviridae .
Ha habido un total de 215 propuestas taxonómicas, que han sido aprobadas y ratificadas desde el 8 ° Informe de ICTV de 2005.
Serotipos
Los nombres de los serotipos de rinovirus humanos tienen la forma HRV- Xn, donde X es la especie de rinovirus (A, B o C) yn es un número índice. Las especies A y B han utilizado el mismo índice, mientras que la especie C tiene un índice separado. Los números de índice válidos son los siguientes:
- Rinovirus A: 1, 2, 7–13, 15, 16, 18–25, 28–34, 36, 38–41, 43–47, 49–51, 53–68, 71 , 73–78, 80–82 , 85, 88–90, 94–96, 98, 100–103
- Rinovirus B: 3–6, 14, 17, 26, 27, 35, 37, 42, 48, 52, 69, 70, 72, 79, 83, 84, 86, 91–93, 97, 99
- Rinovirus C: 1–51
Estructura
Los rinovirus tienen genomas de ARN de sentido positivo monocatenario de entre 7200 y 8500 nt de longitud. En el extremo 5 'del genoma hay una proteína codificada por virus y, como en el ARNm de mamíferos, hay una cola poli-A 3' . Las proteínas estructurales están codificadas en la región 5 'del genoma y no estructurales en el extremo 3'. Esto es igual para todos los picornavirus . Las partículas virales en sí mismas no están envueltas y tienen una estructura icosaédrica .
Las proteínas virales se traducen como un único polipéptido largo, que se escinde en proteínas virales estructurales y no estructurales. [15]
Los rinovirus humanos están compuestos por una cápside que contiene cuatro proteínas virales , VP1, VP2, VP3 y VP4. [16] [17] VP1, VP2 y VP3 forman la mayor parte de la cápside proteica. La proteína VP4, mucho más pequeña, tiene una estructura más extendida y se encuentra en la interfaz entre la cápside y el genoma del ARN. Hay 60 copias de cada una de estas proteínas ensambladas como un icosaedro . Los anticuerpos son una defensa importante contra la infección con los epítopos que se encuentran en las regiones exteriores de VP1-VP3.
Nuevos fármacos antivirales
Se demostró que el interferón alfa utilizado por vía intranasal es eficaz contra las infecciones por rinovirus humanos. Sin embargo, los voluntarios tratados con este fármaco experimentaron algunos efectos secundarios, como hemorragia nasal, y comenzaron a desarrollar tolerancia al fármaco. Posteriormente, se abandonó la investigación sobre el tratamiento. [18]
Pleconaril es un fármaco antiviral biodisponible por vía oral que se está desarrollando para el tratamiento de infecciones causadas por picornavirus . [19] Este fármaco actúa uniéndose a una bolsa hidrófoba en VP1 y estabiliza la cápside de la proteína hasta tal punto que el virus no puede liberar su genoma de ARN en la célula diana. Cuando se probó en voluntarios, durante los ensayos clínicos, este medicamento provocó una disminución significativa en las secreciones de moco y los síntomas asociados con la enfermedad . Pleconaril no está disponible actualmente para el tratamiento de infecciones rinovirales humanas, ya que su eficacia en el tratamiento de estas infecciones está bajo evaluación adicional. [20]
Otras sustancias como Iota-Carragenina pueden formar la base para la creación de medicamentos para combatir el rinovirus humano. [21]
En el asma, los rinovirus humanos se han asociado recientemente con la mayoría de las exacerbaciones del asma para las que la terapia actual es inadecuada. La molécula de adhesión intercelular 1 (ICAM-1) tiene un papel central en la inflamación de las vías respiratorias en el asma y es el receptor del 90% de los rinovirus humanos. La infección por rinovirus humano del epitelio de las vías respiratorias induce ICAM-1.
La desloratadina y la loratadina son compuestos que pertenecen a la nueva clase de bloqueadores del receptor H1 . Las propiedades antiinflamatorias de los antihistamínicos se han documentado recientemente, aunque los mecanismos moleculares subyacentes no están completamente definidos. Es poco probable que estos efectos estén mediados por el antagonismo del receptor H1 y sugieren un nuevo mecanismo de acción que puede ser importante para el control terapéutico de las exacerbaciones del asma inducidas por virus. [ cita requerida ]
En 2018, investigadores del Imperial College London y colegas de la Universidad de York y el Instituto Pirbright informaron sobre una nueva serie de compuestos antirrinovirales . Estas moléculas se dirigen a la N- miristoiltransferasa humana , una enzima en la célula huésped que requiere el picornavirus para ensamblar su cápside viral y generar así un virión infeccioso. El compuesto principal de esta serie, IMP-1088 , inhibió de forma muy potente la miristoilación del huéspedde la proteína de la cápside viral y evitó la formación de virus infecciosos, rescatando la viabilidad de las células en cultivo que habían estado expuestas a una variedad de serotipos de rinovirus, oa picornavirus relacionados, incluidos el poliovirus y el virus de la fiebre aftosa . [22] Debido a que estos compuestos se dirigen a un factor del huésped, son ampliamente activos contra todos los serotipos, y se cree que es poco probable que puedan ser superados por mutaciones de resistencia en el virus. [22]
Vacuna
No existen vacunas contra estos virus ya que existe poca o ninguna protección cruzada entre los serotipos . Se han secuenciado al menos 99 serotipos de rinovirus humanos que afectan a los seres humanos . [23] [8] Sin embargo, un estudio de la proteína VP4 ha demostrado que está altamente conservada entre muchos serotipos de rinovirus humano, lo que abre el potencial para una futura vacuna de rinovirus humano pan-serotipo. [24] Se obtuvo un resultado similar con la proteína VP1. Al igual que VP4, VP1 también ocasionalmente "sobresale" de la partícula viral, haciéndola disponible para neutralizar los anticuerpos. Ambos péptidos se probaron en conejos, lo que resultó en una generación exitosa de anticuerpos de serotipo cruzado. [25]
La introducción exitosa de ICAM-1 humana en ratones ha eliminado un obstáculo importante en la creación de un modelo animal para la vacunación contra el RV. [25]
Prevención
El rinovirus humano puede permanecer activado hasta tres horas fuera de un huésped humano. Una vez que se contrae el virus, una persona es más contagiosa dentro de los primeros tres días. Las medidas preventivas, como lavarse las manos enérgicamente con regularidad con agua y jabón, pueden ayudar a evitar infecciones. Evitar tocarse la boca, los ojos y la nariz, los puntos de entrada más comunes del rinovirus también pueden ayudar en la prevención. Las precauciones contra las gotitas, que adoptan la forma de una mascarilla quirúrgica y guantes, son el método utilizado en los principales hospitales.
Rinovirus y SARS-CoV-2
Según una investigación [26] del MRC- Científicos del Centro de Investigación de Virus (CVR) de la Universidad de Glasgow , la infección por rinovirus humanos puede bloquear la replicación del SARS-CoV-2 en las células del tracto respiratorio al desencadenar una respuesta de interferón , y puede reducir el COVID- 19 gravedad y carga de morbilidad .
Referencias
- ^ Nicola Davison (6 de octubre de 2017). "¿Por qué no podemos curar el resfriado común?", The Guardian
- ^ Offit, Paul A. (2007). Vacunado; La búsqueda de un hombre para vencer las enfermedades más mortales del mundo . HarperCollins. págs. 66–68. ISBN 978-0-06-122795-0.
- ^ Informes de salud pública . 74 . El servicio. 1959. pág. 9.
- ^ Kennedy, Joshua L; Turner, Ronald B .; Braciale, Thomas; Heymann, Peter W .; Borish, Larry (junio de 2012). "Patogenia de la infección por rinovirus" . Opinión actual en virología . 2 (3): 287-293. doi : 10.1016 / j.coviro.2012.03.008 . ISSN 1879-6257 . PMC 3378761 . PMID 22542099 .
- ^ Kolinski, John M .; Schneider, Tobias M. (2021). "Los eventos de superpropagación sugieren la transmisión por aerosol del SARS-CoV-2 por acumulación en espacios cerrados". Revisión E física . 103 (3): 033109. arXiv : 2007.14807 . doi : 10.1103 / PhysRevE.103.033109 . PMID 33862829 . S2CID 220845868 .
- ^ Foxman EF, Storer JA, Fitzgerald ME, Wasik BR, Hou L, Zhao H, et al. (Enero de 2015). "La defensa innata dependiente de la temperatura contra el virus del resfriado común limita la replicación viral a temperatura cálida en las células de las vías respiratorias del ratón" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 112 (3): 827–32. Código Bibliográfico : 2015PNAS..112..827F . doi : 10.1073 / pnas.1411030112 . PMC 4311828 . PMID 25561542 .
- ^ Jacobs SE, Lamson DM, St George K, Walsh TJ (enero de 2013). "Rinovirus humanos" . Revisiones de microbiología clínica . 26 (1): 135–62. doi : 10.1128 / CMR.00077-12 . PMC 3553670 . PMID 23297263 .
- ^ a b Palmenberg AC, Spiro D, Kuzmickas R, Wang S, Djikeng A, Rathe JA, et al. (Abril de 2009). "La secuenciación y análisis de todos los genomas de rinovirus humanos conocidos revelan estructura y evolución" . Ciencia . 324 (5923): 55–9. Código Bibliográfico : 2009Sci ... 324 ... 55P . doi : 10.1126 / science.1165557 . PMC 3923423 . PMID 19213880 .
- ^ Bochkov YA, Watters K, Ashraf S, Griggs TF, Devries MK, Jackson DJ, et al. (Abril de 2015). "El miembro 3 de la familia relacionada con la cadherina, un producto génico de susceptibilidad al asma infantil, media la unión y la replicación del rinovirus C" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 112 (17): 5485–90. Código bibliográfico : 2015PNAS..112.5485B . doi : 10.1073 / pnas.1421178112 . PMC 4418890 . PMID 25848009 .
- ^ Lessler J, Reich NG, Brookmeyer R, Perl TM, Nelson KE, Cummings DA (mayo de 2009). "Períodos de incubación de infecciones virales respiratorias agudas: una revisión sistemática" . La lanceta. Enfermedades infecciosas . 9 (5): 291–300. doi : 10.1016 / S1473-3099 (09) 70069-6 . PMC 4327893 . PMID 19393959 .
- ^ Fuji N, Suzuki A, Lupisan S, Sombrero L, Galang H, Kamigaki T, et al. (2011). Schulz TF (ed.). "Detección del genoma viral del rinovirus humano C en sangre entre niños con infecciones respiratorias graves en Filipinas" . PLOS ONE . 6 (11): e27247. Código Bibliográfico : 2011PLoSO ... 627247F . doi : 10.1371 / journal.pone.0027247 . PMC 3210775 . PMID 22087272 .
- ^ McCulloch DJ, Sears MH, Jacob JT, Lyon GM, Burd EM, Caliendo AM, et al. (Agosto de 2014). "La gravedad de la infección por rinovirus en adultos hospitalizados no está relacionada con el genotipo" . Revista Estadounidense de Patología Clínica . 142 (2): 165–72. doi : 10.1309 / AJCPHIKRJC67AAZJ . PMC 4332627 . PMID 25015856 .
- ^ Kuypers J, Perchetti GA, Chu HY, Newman KL, Katz J, Khatry SK, et al. (Diciembre de 2019). "Caracterización filogenética de rinovirus de bebés en Sarlahi, Nepal" . Revista de Virología Médica . 91 (12): 2108–2116. doi : 10.1002 / jmv.25563 . PMC 6800797 . PMID 31389049 .
- ^ García J, Espejo V, Nelson M, Sovero M, Villaran MV, Gomez J, Barrantes M, Sanchez F, Comach G, Arango AE, Aguayo N, de Rivera IL, Chicaiza W, Jimenez M, Aleman W, Rodriguez F, Gonzales MS, Kochel TJ, Halsey ES (octubre de 2013). "Rinovirus y enterovirus humanos en enfermedades similares a la influenza en América Latina" . Revista de virología . 10 : 305. doi : 10.1186 / 1743-422x-10-305 . PMC 3854537 . PMID 24119298 .
- ^ Sofá de Robert B (2005). "Rinovirus: replicación" . En Anne O'Daly (ed.). Enciclopedia de Ciencias de la Vida . John Wiley. ISBN 978-0-470-01590-2.
- ^ Rossmann MG, Arnold E, Erickson JW, Frankenberger EA, Griffith JP, Hecht HJ, et al. (1985). "Estructura de un virus del resfriado común humano y relación funcional con otros picornavirus". Naturaleza . 317 (6033): 145–53. Código Bibliográfico : 1985Natur.317..145R . doi : 10.1038 / 317145a0 . PMID 2993920 . S2CID 4288590 .
- ^ Smith TJ, Kremer MJ, Luo M, Vriend G, Arnold E, Kamer G, et al. (Septiembre de 1986). "El sitio de unión en el rinovirus humano 14 para los agentes antivirales que inhiben el desprendimiento". Ciencia . 233 (4770): 1286–93. Código Bibliográfico : 1986Sci ... 233.1286S . doi : 10.1126 / science.3018924 . PMID 3018924 .
- ^ Farr BM, Gwaltney JM, Adams KF, Hayden FG (julio de 1984). "Interferón-alfa 2 intranasal para la prevención de resfriados naturales por rinovirus" . Agentes antimicrobianos y quimioterapia . 26 (1): 31–4. doi : 10.1128 / aac.26.1.31 . PMC 179911 . PMID 6089652 .
- ^ Pevear DC, Tull TM, Seipel ME, Groarke JM (septiembre de 1999). "Actividad de pleconaril contra enterovirus" . Agentes antimicrobianos y quimioterapia . 43 (9): 2109-15. doi : 10.1128 / AAC.43.9.2109 . PMC 89431 . PMID 10471549 .
- ^ Fleischer R, Laessig K (diciembre de 2003). "Evaluación de la seguridad y eficacia del pleconaril para el tratamiento del resfriado común" . Enfermedades Clínicas Infecciosas . 37 (12): 1722. doi : 10.1086 / 379830 . PMID 14689362 .
- ^ Grassauer A, Weinmuellner R, Meier C, Pretsch A, Prieschl-Grassauer E, Unger H (septiembre de 2008). "Iota-carragenina es un potente inhibidor de la infección por rinovirus" . Revista de virología . 5 : 107. doi : 10.1186 / 1743-422X-5-107 . PMC 2562995 . PMID 18817582 .
- ^ a b Mousnier A, Bell AS, Swieboda DP, Morales-Sanfrutos J, Pérez-Dorado I, Brannigan JA, et al. (Junio de 2018). "Los inhibidores derivados de fragmentos de la N-miristoiltransferasa humana bloquean el ensamblaje de la cápside y la replicación del virus del resfriado común" . Química de la naturaleza . 10 (6): 599–606. Código bibliográfico : 2018NatCh..10..599M . doi : 10.1038 / s41557-018-0039-2 . PMC 6015761 . PMID 29760414 .
- ^ Mary Engel (13 de febrero de 2009). "Los genomas de las cepas de rinovirus decodificados; la cura para el resfriado es poco probable: las cepas son probablemente demasiado diferentes para que un solo tratamiento o vacuna se aplique a todas las variedades, dicen los científicos" . Los Angeles Times .
- ^ Katpally U, Fu TM, Freed DC, Casimiro DR, Smith TJ (julio de 2009). "Los anticuerpos contra el extremo N enterrado del rinovirus VP4 exhiben neutralización serotípica cruzada" . Revista de Virología . 83 (14): 7040–8. doi : 10.1128 / JVI.00557-09 . PMC 2704786 . PMID 19403680 .
- ↑ a b Katpally U, Fu TM, Freed DC, Casimiro DR, Smith TJ (julio de 2009). "Los anticuerpos contra el extremo N enterrado del rinovirus VP4 exhiben neutralización serotípica cruzada" . Revista de Virología . 83 (14): 7040–8. doi : 10.1128 / JVI.00557-09 . PMC 4291752 . PMID 19403680 .
- ^ Kieran Dee, Daniel M Goldfarb, Joanne Haney, Julien AR Amat, Vanessa Herder, Meredith Stewart, Agnieszka M Szemiel, Marc Baguelin, Pablo R Murcia. "La infección por rinovirus humanos bloquea la replicación del SARS-CoV-2 dentro del epitelio respiratorio: implicaciones para la epidemiología de COVID-19" . La Revista de Enfermedades Infecciosas .CS1 maint: varios nombres: lista de autores ( enlace )
enlaces externos
- VIDEO: Rhinovirus, the Old, the New and the UW James E. Gern, MD, habla en la Facultad de Medicina y Salud Pública de la Universidad de Wisconsin, 2008.
- ¿Qué tamaño tiene un rinovirus humano? (animación)
- Infecciones virales del tracto respiratorio
- Enterovirus