Energía superficial
La energía libre superficial o la energía libre interfacial o la energía superficial cuantifica la ruptura de los enlaces intermoleculares que se produce cuando se crea una superficie. En la física de los sólidos , las superficies deben ser intrínsecamente menos favorables desde el punto de vista energético que la mayor parte de un material (las moléculas en la superficie tienen más energía en comparación con las moléculas en la mayor parte del material), de lo contrario habría una fuerza impulsora para que las superficies se ser creado, eliminando la mayor parte del material (ver sublimación). Por lo tanto, la energía superficial puede definirse como el exceso de energía en la superficie de un material en comparación con el volumen, o es el trabajo requerido para construir un área de una superficie particular. Otra forma de ver la energía superficial es relacionarla con el trabajo requerido para cortar una muestra a granel, creando dos superficies. Hay un "exceso de energía" como resultado de la unión ahora incompleta y no realizada en las dos superficies.
Cortar un cuerpo sólido en pedazos rompe sus enlaces y aumenta el área de la superficie y, por lo tanto, aumenta la energía de la superficie. Si el corte se realiza de forma reversible , la conservación de energía significa que la energía consumida por el proceso de corte será igual a la energía inherente a las dos nuevas superficies creadas. La energía superficial unitaria de un material sería, por tanto, la mitad de su energía de cohesión , en igualdad de condiciones; en la práctica, esto solo es cierto para una superficie recién preparada al vacío. Las superficies a menudo cambian su forma fuera del modelo simple de "unión escindida" que se acaba de dar a entender anteriormente. Se encuentra que son regiones altamente dinámicas, que se reorganizan o reaccionan fácilmente, por lo que la energía a menudo se reduce mediante procesos como la pasivación.o adsorción .
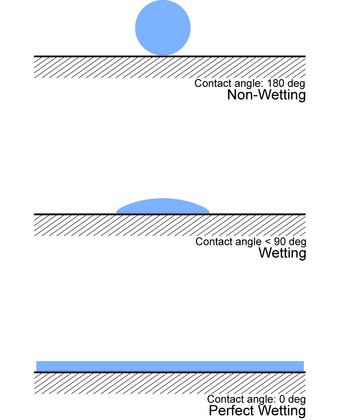
La forma más común de medir la energía superficial es mediante experimentos de ángulos de contacto . [1] En este método, el ángulo de contacto de la superficie se mide con varios líquidos, generalmente agua y diyodometano . Con base en los resultados del ángulo de contacto y conociendo la tensión superficial de los líquidos, se puede calcular la energía superficial. En la práctica, este análisis se realiza automáticamente mediante un medidor de ángulo de contacto. [2]
Hay varios modelos diferentes para calcular la energía superficial en función de las lecturas del ángulo de contacto. [3] El método más comúnmente utilizado es OWRK, que requiere el uso de dos líquidos de sonda y da como resultado la energía superficial total y la divide en componentes polares y dispersivos.
El método del ángulo de contacto es el método estándar de medición de energía superficial debido a su simplicidad, aplicabilidad a una amplia gama de superficies y rapidez. La medición se puede automatizar completamente y está estandarizada. [4]
La energía superficial de un líquido se puede medir estirando una membrana líquida (lo que aumenta el área de la superficie y, por lo tanto, la energía de la superficie). En ese caso, para aumentar el área de superficie de una masa de líquido en una cantidad, δA , se necesita una cantidad de trabajo , γ δA (donde γ es la densidad de energía superficial del líquido). Sin embargo, tal método no puede usarse para medir la energía superficial de un sólido porque el estiramiento de una membrana sólida induce energía elástica en el volumen además de aumentar la energía superficial.