| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC cloruro de cobalto tris (etilendiamina) | |||
| Otros nombres cloruro de tris (etilendiamina) cobalto (III) | |||
| Identificadores | |||
| |||
Tablero CompTox ( EPA ) | |||
| Propiedades | |||
| C 6 H 24 N 6 Cl 3 Co | |||
| Masa molar | 345,59 | ||
| Apariencia | sólido amarillo anaranjado | ||
| Punto de fusion | 275 ° C (527 ° F; 548 K) (se descompone) | ||
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). | |||
| Referencias de Infobox | |||
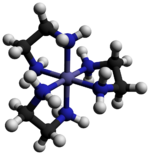
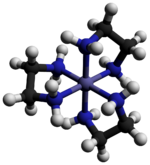
El cloruro de tris (etilendiamina) cobalto (III) es un compuesto inorgánico con la fórmula [Co (en) 3 ] Cl 3 (donde "en" es la abreviatura de etilendiamina ). Es la sal de cloruro del complejo de coordinación [Co (en) 3 ] 3+ . Esta tricación fue importante en la historia de la química de coordinación debido a su estabilidad y su estereoquímica . Se han descrito muchas sales diferentes. El complejo fue descrito por primera vez por Alfred Werner, quien aisló esta sal como cristales en forma de aguja de oro amarillo. [1]
Síntesis y estructura [ editar ]
El compuesto se prepara a partir de una solución acuosa de etilendiamina y prácticamente cualquier sal de cobalto (II), tal como cloruro de cobalto (II) . La solución se purga con aire para oxidar los complejos de cobalto (II) -etilendiamina a cobalto (III). La reacción transcurre con un rendimiento del 95% y el tri catión se puede aislar con una variedad de aniones. Un análisis detallado del producto de una síntesis a gran escala reveló que un subproducto menor era [Co (en) 2 Cl (H 2 NCH 2 CH 2 NH 3 )] Cl 3 , que contiene un ligando de etilendiamina monodentado raro (protonado). [2]
El catión [Co (en) 3 ] 3+ es octaédrico con distancias Co-N en el rango de 1.947–1.981 Å . Los ángulos N-Co-N son 85 ° dentro de los anillos quelatos y 90 ° entre átomos de nitrógeno en anillos adyacentes. [3]
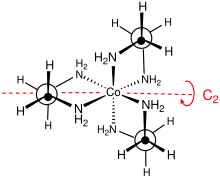
Estereoquímica [ editar ]
El grupo de puntos de este complejo es D 3 . El complejo se puede resolver en enantiómeros que se describen como Δ y Λ. Por lo general, la resolución implica el uso de sales de tartrato . [4] La resolución óptica es un componente estándar de los cursos de síntesis inorgánica. [5] Debido a su falta de planitud, los anillos MN 2 C 2 pueden adoptar cualquiera de las dos conformaciones , que se describen mediante los símbolos λ y δ. El registro entre estas conformaciones de anillo y la configuración absoluta de los centros metálicos se describe mediante la nomenclatura lel (cuando la columna vertebral en se encuentra paralela a la C 3eje de simetría) u ob (cuando la columna vertebral en es anverso a este mismo eje C 3 ). Por tanto, se pueden identificar las siguientes conformaciones diastereoisómeras : Δ- ( lel ) 3 , Δ- (lel) 2 (ob), Δ- (lel) (ob) 2 y Δ- ( ob ) 3 . Las imágenes de espejo de estas especies, por supuesto, también existen. [6]
Hidrata [ editar ]
Los complejos de coordinación catiónica de amoniaco y alquilaminas cristalizan típicamente con agua en la red , y la estequiometría puede depender de las condiciones de cristalización y, en los casos de complejos quirales, de la pureza óptica del catión. Racémica [Co (en) 3 ] Cl 3 es más a menudo obtiene como el di- o trihidrato. Para la sal ópticamente pura (+) - [Co (en) 3 ] Cl 3 · 1.5H 2 O, (+) - [Co (en) 3 ] Cl 3 · 0.5NaCl · 3H 2 O, y (+) - [Co (en) 3 ] Cl 3 · H 2 O también se conocen. [3]
Referencias [ editar ]
- ^ A. Werner (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V" . Chemische Berichte . 45 (1): 121–130. doi : 10.1002 / cber.19120450116 .
- ^ Jack M. Harrowfield; Mark I. Ogden; Brian W. Skelton; Allan H. White (2005). "Alfred Werner revisitado: algunas sutilezas de la síntesis e isomería de iones complejos". Comptes Rendus Chimie . 8 (2): 121-128. doi : 10.1016 / j.crci.2004.10.013 . hdl : 20.500.11937 / 8231 .
- ^ a b D. Witiak, JC Clardy y DS Martin, Jnr. (1972). "La estructura cristalina de (+) - D-tris (etilendiamina) cobalto (III) nitrato". Acta Crystallographica . B28 (9): 2694–2699. doi : 10.1107 / S056774087200679X .CS1 maint: varios nombres: lista de autores ( enlace )
- ^ JA Broomhead, FP Dwyer, JW Hogarth (1960). Resolución del ión Tris (Etilendiamina) Cobalto (III) . Síntesis inorgánica. VI . págs. 183–186. doi : 10.1002 / 9780470132371.ch58 . ISBN 9780470132371.Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Girolami, GS; Rauchfuss, TB y Angelici, RJ, Síntesis y técnica en química inorgánica, Libros de ciencias universitarios: Mill Valley, CA, 1999 ISBN 0-935702-48-2
- ^ von Zelewsky, A. "Estereoquímica de compuestos de coordinación" John Wiley: Chichester, 1995 ISBN 047195599X .